Nguyên tắc điều chế kim loại và các phương pháp điều chế kim loại được tổng hợp đưa ra nguyên tắc điều chế kim loại, cũng như các dạng bài tập điều chế kim loại giúp các bạn học sinh có thể ghi nhớ vận dụng các phương pháp điều chế kim loại vào các dạng bài tập câu hỏi. Mời các bạn tham khảo.
Mục lục bài viết
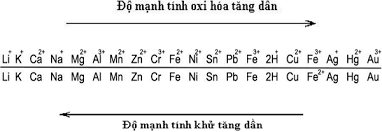
1. Kim loại là gì?
Kim loại là một nhóm các nguyên tố hóa học có thể tạo ra các ion dương (cation) và có các liên kết kim loại. Các kim loại có nhiều đặc tính vật lý và hóa học khác nhau, nhưng chúng đều có đặc điểm chung là có ánh kim, dễ kéo dài và dát mỏng, có khả năng dẫn nhiệt và điện tốt. Kim loại được phân loại theo nhiều tiêu chí, như khối lượng riêng, điểm nóng chảy, độ hoạt động hóa học, màu sắc, v.v. Các kim loại có vai trò quan trọng trong nhiều lĩnh vực của cuộc sống con người, từ công nghiệp, nông nghiệp, y tế cho đến nghệ thuật và trang sức.
2. Nguyên tắc và phương pháp điều chế kim loại:
Điều chế kim loại là quá trình khử ion kim loại trong hợp chất thành nguyên tử kim loại. Điều chế kim loại có thể thực hiện bằng ba phương pháp chính: điện phân, nhiệt luyện và thủy luyện.
2.1. Phương pháp thủy luyện:
Phương pháp thủy luyện là phương pháp dùng để điều chế các kim loại có tính khử yếu, như Au, Ag, Hg, Cu,…
Nguyên tắc: Cơ sở của phương pháp này là dùng những dung dịch thích hợp, như dung dịch H2SO4, NaOH, NaCN… để khử ion kim loại trong hợp chất thành kim loại nguyên chất. Ví dụ:
– Điều chế bạc bằng phương pháp thủy luyện: Dùng dung dịch NaOH để tạo kết tủa Ag2O, sau đó dùng dung dịch glucose để khử Ag2O thành Ag.
AgNO3 + NaOH -> Ag2O + NaNO3
Ag2O + C6H12O6 -> 2Ag + C6H12O7
– Điều chế vàng bằng phương pháp thủy luyện: Dùng dung dịch NaCN để tạo phức [Au(CN)2]-, sau đó dùng dung dịch ZnSO4 để khử [Au(CN)2]- thành Au.
4Au + 8NaCN + O2 + 2H2O -> 4Na[Au(CN)2] + 4NaOH
2Na[Au(CN)2] + Zn -> Na2[Zn(CN)4] + 2Au
2.2. Phương pháp nhiệt luyện:
Nguyên tắc: Phương pháp nhiệt luyện là một phương pháp sử dụng nhiệt độ cao để khử các ion kim loại trong hợp chất bằng các chất khử như C, CO, H2, Al hoặc các kim loại hoạt động. Phương pháp này được dùng để điều chế các kim loại có mức hoạt động trung bình như Zn, Fe, Sn, Pb, …
Một số ví dụ về phương pháp điều chế kim loại nhiệt luyện là:
– Điều chế sắt từ quặng sắt bằng cách nung nóng quặng với than cốc trong lò cao. Phản ứng xảy ra như sau: Fe2O3 + 3C → 2Fe + 3CO.
– Điều chế kẽm từ quặng kẽm bằng cách nung nóng quặng với than cốc trong lò điện. Phản ứng xảy ra như sau: ZnO + C → Zn + CO.
– Điều chế nhôm từ quặng bô xít bằng cách khử Al2O3 bằng Al trong lò điện. Phản ứng xảy ra như sau: Al2O3 + 2Al → 4Al + O2.
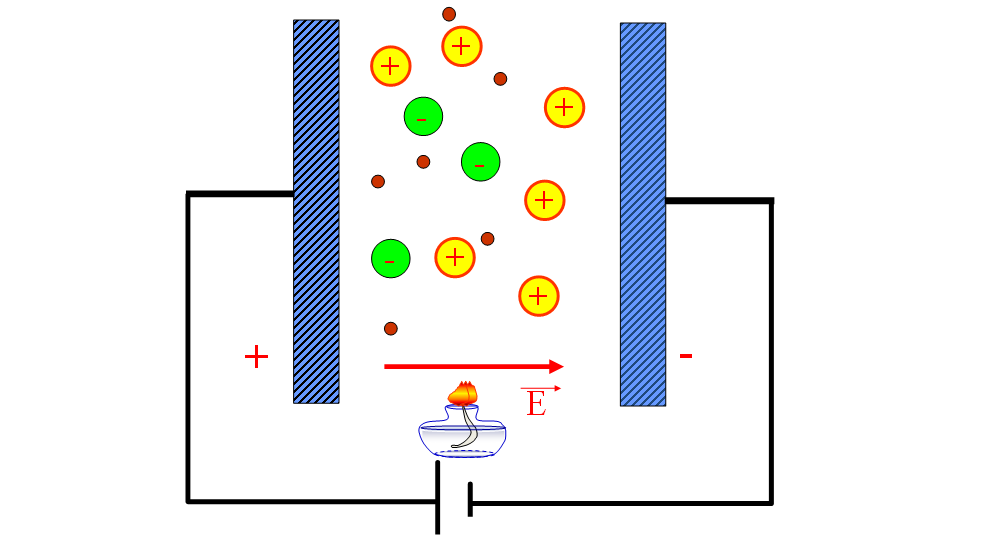
2.3. Phương pháp điện phân:
Nguyên tắc: Phương pháp điện phân là một phương pháp sử dụng dòng điện một chiều để khử các ion kim loại trong dung dịch hoặc nóng chảy của hợp chất của kim loại. Phương pháp này được dùng để điều chế các kim loại có tính hoạt động mạnh như K, Na, Ca, Mg, Al…
Để điều chế kim loại bằng phương pháp điện phân, ta cần có một nguồn điện một chiều, hai điện cực và một dung dịch hoặc nóng chảy của hợp chất của kim loại. Điện cực âm (cathode) là nơi các ion kim loại chạy về và bị khử tạo thành kim loại bám vào điện cực. Điện cực dương (anode) là nơi các ion không phải kim loại (như Cl-, O2-, F-) hút về và bị oxy hóa tạo thành các phi kim như Cl2, O2, F2…
Ví dụ: Để điều chế K kim loại, ta có thể dùng các phương pháp sau:
– Điện phân dung dịch KCl có vách ngăn xốp. Tại cathode: K+ + e- -> K Tại anode: 2Cl- -> Cl2 + 2e-
– Điện phân KCl nóng chảy. Tại cathode: K+ + e- -> K Tại anode: 2Cl- -> Cl2 + 2e-
– Dùng Li để khử K ra khỏi dd KCl. Li + K+ -> Li+ + K
– Dùng CO để khử K ra khỏi K2O. CO + K2O -> CO2 + 2K
Ngoài ra, còn có một số phương pháp điều chế kim loại khác như phân hủy nhiệt, giảm trực tiếp, thuỷ kim… .
3. Tác hại của điều chế kim loại:
Điều chế kim loại có vai trò quan trọng trong công nghiệp, khoa học và đời sống, nhưng cũng gây ra một số tác hại cho môi trường và sức khỏe con người. Một số tác hại của điều chế kim loại là:
– Gây ô nhiễm không khí do khí thải từ các nhà máy luyện kim, chứa các chất độc hại như lưu huỳnh, nitơ, carbon và các kim loại nặng.
– Gây ô nhiễm nước do rò rỉ hoặc xả thải các dung dịch hóa chất từ quá trình điều chế kim loại, ảnh hưởng đến sinh vật sống trong nước và nguồn nước sạch.
– Gây ô nhiễm đất do tích tụ các kim loại nặng trong đất, làm giảm khả năng sinh sản của đất và gây ngộ độc cho cây trồng và động vật.
– Gây nguy hiểm cho sức khỏe con người do tiếp xúc với các hợp chất kim loại trong quá trình điều chế hoặc sử dụng kim loại, có thể gây ra các bệnh như ung thư, chấn thương não, suy thận, xơ gan và tử vong.
4. Giải pháp phòng ngừa tác hại của điều chế kim loại:
– Áp dụng các công nghệ tiên tiến và hiệu quả trong điều chế kim loại, như sử dụng các thiết bị tiết kiệm năng lượng, tái chế và tái sử dụng các nguyên liệu và sản phẩm phụ, lựa chọn các phương pháp điều chế ít gây ô nhiễm hơn, như điện phân thay vì luyện kim.
– Thực hiện các biện pháp kiểm soát và xử lý các chất thải và khí thải từ quá trình điều chế kim loại, như sử dụng các bộ lọc, thiết bị hấp thụ, xử lý sinh học, hoặc tiêu hủy an toàn các chất thải nguy hại.
– Nâng cao nhận thức và trách nhiệm của các doanh nghiệp và người lao động trong ngành điều chế kim loại về việc tuân thủ các quy định về bảo vệ môi trường và an toàn lao động, như thực hiện các biện pháp phòng ngừa tai nạn, sử dụng các thiết bị bảo hộ cá nhân, tham gia các khóa đào tạo và tuyên truyền về môi trường.
– Tăng cường sự giám sát và kiểm tra của các cơ quan chức năng đối với hoạt động điều chế kim loại, như ban hành và thực thi các tiêu chuẩn, quy chuẩn kỹ thuật, quy định về giới hạn khí thải và xả thải, áp dụng các biện pháp xử phạt vi phạm.
– Khuyến khích sự hợp tác và liên kết giữa các bên liên quan trong việc phòng ngừa tác hại của điều chế kim loại, như giữa các doanh nghiệp trong ngành, giữa ngành công nghiệp và khoa học công nghệ, giữa chính quyền và xã hội dân sự, nhằm chia sẻ kinh nghiệm, thông tin, tài nguyên và giải pháp.
5. Một số dạng bài tập về điều chế kim loại:
– Bài tập 1: Cho biết cách điều chế các kim loại sau từ quặng của chúng: sắt, nhôm, đồng, kẽm, magiê.
Lời giải:
– Điều chế sắt: Quặng sắt chính là hematit (Fe2O3) hoặc magie (Fe3O4). Quặng sắt được nung nóng trong lò cao với than cốc và vôi để khử ôxyd và loại bỏ các tạp chất. Sản phẩm thu được là sắt lỏng và xỉ sắt. Sắt lỏng được đúc thành các khối hoặc thanh để sử dụng.
– Điều chế nhôm: Quặng nhôm chính là bô xít (Al2O3). Quặng bô xít được hòa tan trong dung dịch natri hiđroxit để tạo thành natri aluminat (NaAlO2). Sau đó, natri aluminat được phản ứng với khí CO2 để tạo ra nhôm hiđroxit (Al(OH)3). Nhôm hiđroxit được nung nóng để tạo ra nhôm ôxyd (Al2O3). Nhôm ôxyd được điện phân trong dung dịch cryolit (Na3AlF6) để thu được nhôm kim loại và khí ôxy.
– Điều chế đồng: Quặng đồng chính là malachit (CuCO3.Cu(OH)2) hoặc azurit (2CuCO3.Cu(OH)2). Quặng đồng được nung nóng để tạo ra đồng ôxyd (CuO) và khí CO2. Đồng ôxyd được khử bằng than cốc để thu được đồng kim loại và khí CO.
– Điều chế kẽm: Quặng kẽm chính là kẽm blenđ (ZnS) hoặc kẽm cacbonat (ZnCO3). Quặng kẽm được nung nóng với không khí để tạo ra kẽm ôxyd (ZnO) và khí SO2 hoặc CO2. Kẽm ôxyd được khử bằng than cốc để thu được kẽm kim loại và khí CO.
– Điều chế magiê: Quặng magiê chính là magneit (MgCO3) hoặc dolomit (CaCO3.MgCO3). Quặng magiê được nung nóng để tạo ra magiê ôxyd (MgO) và khí CO2. Magiê ôxyd được điện phân trong dung dịch muối magiê để thu được magiê kim loại và khí ôxy.
– Bài tập 2: Tính khối lượng kim loại sắt thu được khi điều chế từ 100g quặng sắt (III) oxit (Fe2O3) bằng than đá (C).
Lời giải:
Phương trình phản ứng:
Fe2O3 + 3C -> 2Fe + 3CO
Theo định luật bảo toàn khối lượng, ta có:
m(Fe2O3) : m(C) : m(Fe) = 160 : 36 : 112
Suy ra:
m(Fe) = m(Fe2O3) x 112/160 = 100 x 112/160 = 70 (g)
Đáp số: 70g
– Bài tập 3: Tính khối lượng Fe thu được khi cho 5,6 gam Fe2O3 tác dụng với lượng dư C.
Lời giải: Công thức phản ứng là Fe2O3 + 3C -> 2Fe + 3CO. Số mol Fe2O3 là 5,6/160 = 0,035 mol. Theo tỉ lệ mol, số mol Fe thu được là 0,035 x 2 = 0,07 mol. Khối lượng Fe thu được là 0,07 x 56 = 3,92 gam.
– Bài tập 4: Tính khối lượng Al thu được khi cho 27 gam Al2O3 tác dụng với lượng dư NaOH trong nước.
Lời giải: Công thức phản ứng là Al2O3 + 2NaOH + 3H2O -> 2NaAl(OH)4. Số mol Al2O3 là 27/102 = 0,265 mol. Theo tỉ lệ mol, số mol Al thu được là 0,265 x 2 = 0,53 mol. Khối lượng Al thu được là 0,53 x 27 = 14,31 gam.
– Bài tập 5: Tính khối lượng Cu thu được khi cho dung dịch CuSO4 tác dụng với thanh sắt có khối lượng là 11,2 gam.
Lời giải: Công thức phản ứng là CuSO4 + Fe -> Cu + FeSO4. Số mol Fe là 11,2/56 = 0,2 mol. Theo tỉ lệ mol, số mol Cu thu được là bằng số mol Fe. Khối lượng Cu thu được là 0,2 x 64 = 12,8 gam.