Mục lục bài viết
1. Phương trình phản ứng phân tử NaHCO3 + H2SO4:
2NaHCO3 + H2SO4 → Na2SO4 + 2CO2 + 2H2O
– Điều kiện phản ứng NaHCO3 ra Na2SO4
– Điều kiện xảy ra phản ứng trên ở điều kiện Nhiệt độ thường
– Phương trình ion rút gọn NaHCO3 + H2SO4 là
2NaHCO3 + H2SO4 → Na2SO4 + 2CO2 + 2H2O
Phương trình ion rút gọn:
HCO3- + H+ → CO2 + H2O
– Hiện tượng phản ứng khi cho dung dịch NaHCO3 tác dụng H2SO4
Khi Cho dung dịch NaHCO3 tác dụng H2SO4 ta sẽ thấy xuất hiện khí không màu thoát ra.
2.Tìm hiểu về NaHCO3 và H2SO4:
2.1. Tìm hiểu về NaHCO3:
a.Khái niệm:
Natri Hydrocacbonat là hợp chất thường ở dạng bột mịn, màu trắng, dễ hút ẩm nhưng ít tan trong nước. Với sự có mặt của các ion H +, CO2 được tạo ra. Natri hiđrocacbonat có công thức hóa học là NaHCO3.
Một số tên gọi thông dụng khác của Natri Hiđrocacbonat trong thực phẩm được biết đến như: muối ăn đêm, bột đêm, natri bicacbonat, natri hiđrocacbonat, muối nở. Vì được sử dụng rất phổ biến trong thực phẩm nên nó còn có nhiều tên gọi khác như: soda nấu ăn, soda bicarbonate, soda bánh mì,… Mặc dù soda là tên gọi chung của muối Na2CO3 và NaHCO3 nhưng thực tế nó thường được gọi là Natri bicacbonat là muối nở và Natri cacbonat là soda.
b. Tính chất vật lý của NaHCO3:
Natri bicacbonat, tức là muối nở, là một chất rắn màu trắng với các tinh thể đơn nghiêng và dạng bột, hơi mặn và có mùi hôi tương tự như mùi của xút tẩy rửa.
– Khác với nhiều muối hiđrocacbonat và muối của các kim loại khác. NaHCO3 ít tan trong nước và đôi khi có thể được coi là không tan.
Ngoài ra, được tìm thấy tự nhiên trong núm vú ở những nơi có hoặc từng có nước bọt, chất tẩy rửa này được tạo ra từ hàng ngàn năm trước khi sông và hồ bị bốc hơi nhanh chóng do nhiệt độ cao. .
c.Tính chất hóa học của NaHCO3:
– Natri bicacbonat là muối axit có nguyên tử H di động trong thành phần gốc axit, thể hiện tính axit yếu. Tuy nhiên, do NaHCO3 là muối của axit yếu (H2CO3) nên có thể phản ứng với axit mạnh hơn (ví dụ: HCl…), giải phóng CO2 nên NaHCO3 cũng có thể đóng vai trò là bazơ, và tính chất này được tận dụng . tính axit
Trong dung dịch nước, NaHCO3 bị thủy phân tạo thành bazơ yếu
NaHCO3 + H2O → NaOH + H2CO3
Môi trường này có thể làm đổi màu quỳ tím nhưng không đủ mạnh để làm đổi màu dung dịch phenolphtalein.
Tác dụng với axit mạnh tạo thành muối và nước, giải phóng CO2
2NaHCO3 + H2SO4 → Na2SO4 + 2H2O + 2CO2
Tác dụng với bazơ tạo muối mới và bazơ mới
NaHCO3 + Ca(OH)2 → CaCO3 + NaOH + H2O
hoặc tạo hai vùng mới:
2NaHCO3 + Ca(OH)2 → CaCO3 + Na2CO3 + 2H2O
d.Điều chế/Sản xuất Natri Hydrocacbonat:
– Điều chế natri bicacbonat hóa học bằng cách cho canxi cacbonat, natri clorua, amoniac và cacbonat điôxít phản ứng trong nước.
– Cho khí cacbonat đioxit phản ứng với dung dịch natri hiđroxit trong nước thu được natri cacbonat. Sau đó, chúng tôi thêm carbon dioxide để tạo ra sản phẩm natri bicacbonat, tiếp theo là nồng độ đủ cao để thu được muối khô:
CO2 + 2NaOH → Na2CO3 + H2O
Na2CO3 + CO2 + H2O → 2Na2CO3
– Soda tro được hòa tan trong nước và xử lý bằng carbon dioxide, cuối cùng natri bicarbonate được tạo ra ở dạng rắn:
Na2CO3 + CO2 + H2O → 2NaHCO3
e. Ứng dụng:
*Trong linh vực thực phẩm
Đây là một trong những công dụng của baking soda mà chúng ta có thể thường xuyên bắt gặp trong công nghiệp chế biến. Nó giúp tạo độ giòn cho bánh quy, bánh quy giòn, bánh quy. Ngoài ra, để bổ sung phần trung hòa làm giảm lượng axit trong nước giải khát, người ta sử dụng nó như một chất phụ gia an toàn và hiệu quả cao. Hơn nữa, natri bicacbonat còn có tác dụng làm mềm một số loại thực phẩm và có tác dụng làm đẹp, tăng tính thẩm mỹ cho bánh.
Một điều thú vị nữa là nó còn có tác dụng làm đẹp cho bánh như một loại bột đêm. Được sử dụng rất hiệu quả giúp hỗ trợ làm gia vị trong các món thịt, ninh xương.
NaHCO3 là thực phẩm
Baking Soda Giúp Bánh Giòn, Bồng Bềnh Hơn
*Trọng linh vực y tế
Đóng vai trò là chất dùng trong việc trung hòa axit, góp phần điều trị các bệnh liên quan đến dạ dày như nóng trong, khó tiêu. Là một thành phần trong áo choàng tắm hoặc được sử dụng trực tiếp để loại bỏ mảng bám và làm sạch răng bằng cách chà xát lên răng. Có công dụng giảm lượng dầu trên da đầu, hạn chế mụn trên mặt, giúp tạo bọt và tăng độ pH trong một số loại bọt.
NaHCO3 là thức uống y tế
Ứng dụng của NaHCO3 trong điều trị bệnh
*Những ứng dụng khác
NaHCO3 trong các ứng dụng khác:
Dùng trong tẩy rửa, làm sạch dụng cụ nhà bếp, chống lại một số loại chất sát trùng.
Ứng dụng trong xử lý nước thải, chăm sóc sức khỏe và sắc đẹp, trong ngành cao su, da thuộc, nhiên liệu.
2.2. Tìm hiểu về H2SO4:
a.Khái niệm:
Axit sunfuric là một axit vô cơ bao gồm lưu huỳnh, oxy và hydro. H2SO4 là một hóa chất không mùi, không màu và có tính phá hủy, hòa tan trong nước với nhiều tỷ lệ khác nhau và có phản ứng tỏa nhiệt mạnh.
Nó là chất lơ lửng không bay hơi, gần như gấp đôi nước (H2SO4 98% D = 1,84g/cm3) Đặc biệt, do áp suất cao giữa axit sunfuric và nước nên người ta tìm thấy H2SO4 tinh khiết trên mặt đất. .
Bên cạnh đó, H2SO4 còn là một thành phần trong mưa axit và được cấu tạo từ lưu huỳnh đioxit hoặc axit sunfuric bị oxi hóa trong nước. Chúng là một loại hóa chất được sử dụng làm nguyên liệu cũng như chất xúc tác trong nhiều ngành công nghiệp, sản xuất..
Các nước trên thế giới hàng năm sản xuất hơn 150 triệu tấn H2SO4. và sử dụng chúng trong sản xuất thuốc trừ sâu, phân bón, nhựa và sơn hoặc chất tẩy rửa tổng hợp.
Công thức hóa học của axit sunfuric: H2SO4
b. Tính chất vật lý của H2SO4:
Axit sunfuric là chất hóa học tồn tại ở thể lỏng, lơ lửng và nặng hơn nước, tan trong nước và dễ bay hơi.
Axit sunfuric đặc sẽ hút nước mạnh và tỏa nhiều nhiệt nên khi pha dung dịch không được đổ nước vào axit sunfuric mà phải móc từ axit sunfuric nếu không có thể gây kích ứng da.
H2SO4 có thể do các hợp chất hữu cơ than hoạt tính gây ra.
c.Tính chất hóa học của H2SO4:
Tương phản với Axit Sunfuric tồn tại ở định dạng
Axit sunfuric làm quỳ tím chuyển sang màu đỏ.
Tạo thành muối sunfat sunfat khi phản ứng với các kim loại đứng trước H (trừ Pb).
Fe + H2SO4 → FeSO4 + H
Tạo thành muối mới khi phản ứng với các oxit cơ bản (trong đó kim loại vẫn còn hóa trị) và nước.
FeO + H2SO4 → FeSO4 + H2O
Tạo thành muối mới axit sunfuric phản ứng với muối (trong đó kim loại vẫn còn hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
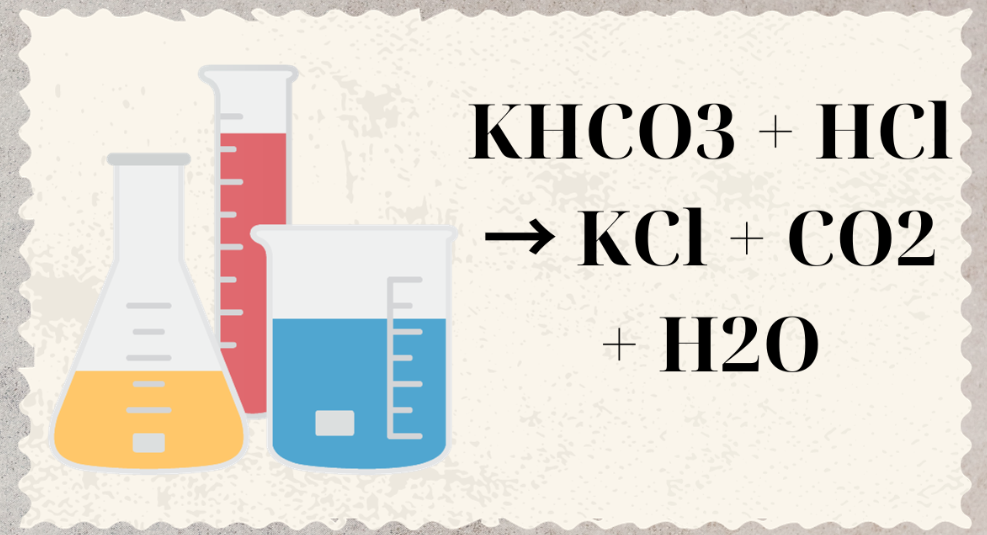
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
Tạo thành muối và nước mới khi axit sunfuric phản ứng với bazơ.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
So sánh với axit sunfuric tồn tại ở dạng đặc trưng
axit sunfuri
Axit sunfuric đặc là một chất oxi hóa mạnh và là một axit mạnh, có các tính chất sau
Tác dụng với kim loại: Khi cho mẩu Cu vào H2SO4 sinh ra dung dịch màu xanh lam và có khí bay ra mùi khai.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Phản ứng với phi kim tạo thành oxit phi kim và nước, giải phóng SO2. khí g
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
Phản ứng với các chất khử khác:
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
H2SO4 còn có tính năng ưa nước đặc trưng như cho H2SO4 vào cốc đựng đường, sau phản ứng nước đường sẽ chuyển sang màu đen và trào ra theo phương trình hóa học như sau:
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
d. Ứng dụng của axit sunfuric:
-Trọng lượng sản xuất công nghiệp
Axit sunfuric được sử dụng trong các quy trình sản xuất kim loại như tôn, đồng hay dùng làm dung dịch tẩy rửa, tẩy gỉ cho bề mặt sắt thép.
Ngoài ra, H2SO4 còn được sử dụng trong các sản phẩm gốc sunfat. Sản xuất sunfat, tẩy rửa kim loại trước khi mạ điện, sản xuất thuốc nổ, chất dẻo, phân bón, sản xuất thuốc. Hỗn hợp axit và nước được sử dụng làm chất điện phân trong các loại pin khác nhau, axit… Hợp chất axit và nước được sử dụng làm chất điện phân trong các loại pin khác nhau, axit nào…
-Sản xuất phân bón
Axit photphoric điều chế từ H2SO4 được sử dụng để sản xuất phân lân, amoni photphat canxi dihiđrophotphat và cũng được sử dụng để sản xuất amoni sunfat.
-Trong xử lý nước thải
Axit sunfuric được sử dụng trong các nhà máy xử lý nước để loại bỏ tạp chất, trung hòa pH và lọc bỏ các ion Ca2+, Mg2+ có trong môi trường nước thải.
-Trong phòng thí nghiệm
Dùng trong điều chế các axit yếu hạn chế như: HNO3. HCl trong thí nghiệm.
Axit sunfuric còn tạo ra nhiều ứng dụng trong đời sống
3. Bài tập vận dụng liên quan:
Câu 1. Chất nào dưới đây là chất lưỡng tính?
A. Fe(OH)3.
B. Mg(OH)2.
C. NaCl.
D. NaHCO3.
Đáp án D
Câu 2. Dung dịch chất nào dưới đây không làm đổi màu quỳ tím?
A. HCl.
B. K2SO4.
C. Ba(OH)2.
D. HClO4.
Đáp án B
Câu 3. Muối nào dưới đây là muối axit?
A. NH4NO3.
B. Na3PO4.
C. Ca(HCO3)2.
D. CH3COONa.
Đáp án C
Câu 4. Chất nào dưới đây không có tính lưỡng tính?
A. K2CO3.
B. (NH4)2CO3.
C. Al(OH)3.
D. NaHCO3.
Đáp án A
Câu 5. Cho 19,2 gam hỗn hợp muối cacbonat của kim loại hóa trị I và muối cacbonat của kim loại hóa trị II tác dụng với dung dịch HCl dư, thu được 4,48 lít một chất khí (đktc). Tính khối lượng muối tạo ra trong dung dịch trên.
A. 21,4
B. 42,8
C. 32,1
D. 20,4
Đáp án A
Gọi công thức hai muối cacbonat là M2CO3 và M’CO3, ta có:
M2CO3 + 2HCl → 2MCl + CO2 + H2O
M’CO3 + 2HCl → M’Cl2 + CO2 + H2O
Áp dụng phương pháp tăng giảm khối lượng:
1 mol muối cacbonnat tạo thành muối clorua ⇒ khối lượng tăng.
35,5 .2 – 60 = 11 (gam) ⇒ nCO2 = nmuối cacbonat = 0,2(mol)
⇒ mmuối clorua = mmuối cacbonlat + 0,2.11 = 19,2 + 2,2 = 21,4 (gam)