Kim loại nào tác dụng với Lưu huỳnh ở nhiệt độ thường? Trong hóa học, có một số kim loại khác nhau có khả năng tác dụng với Lưu huỳnh khi ở nhiệt độ thông thường. Khi tiếp xúc với Lưu huỳnh, các kim loại này có thể tạo ra các phản ứng hoá học khác nhau, tùy thuộc vào điều kiện và tỷ lệ phản ứng.
Mục lục bài viết
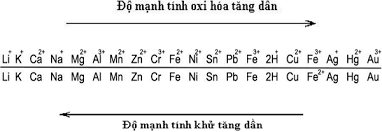
1. Kim loại nào sau đây tác dụng với lưu huỳnh ở nhiệt độ thường:
A. Fe
B. Hg
C. Cu
D. Al
Đáp án hướng dẫn giải chi tiết
Lưu huỳnh là một chất có tính oxi hóa yếu và có khả năng tác dụng với nhiệt độ thường. Trong số các kim loại, Hg (thủy ngân) là một trong những kim loại có khả năng tác dụng với lưu huỳnh mà không cần sự hiện diện của xúc tác hoặc nhiệt độ.
Phản ứng hóa học giữa Hg và S (lưu huỳnh) có thể được biểu diễn như sau:Hg + S → HgS
Trong phản ứng này, Hg (thủy ngân) tác dụng với S (lưu huỳnh) để tạo thành HgS (thuỷ ngân sulfua). Đây là một phản ứng hóa học quan trọng và được sử dụng trong nhiều lĩnh vực khác nhau nhưng đặc biệt phổ biến trong công nghiệp và nghiên cứu khoa học.
Đáp án chính xác là B
2. Tính chất hóa học của lưu huỳnh:
Nguyên tử lưu huỳnh (S) có cấu trúc electron gồm 6 electron nằm ở lớp ngoài cùng, trong đó có 2 electron đơn độc.
Khi tham gia vào các phản ứng hóa học, lưu huỳnh có khả năng thay đổi số oxi hóa với các giá trị: −2; 0; +4; +6.
⟹ Điều này cho thấy lưu huỳnh có tính chất oxi hóa và tính chất khử.
1. Lưu huỳnh có tính chất oxi hóa
Khi lưu huỳnh tác dụng với kim loại hoặc hiđro, số oxi hóa của lưu huỳnh có thể giảm từ 0 xuống −2.
S0 + 2e → S-2
Việc này cho thấy lưu huỳnh thể hiện tính chất oxi hóa khi tác dụng với kim loại và hidro.
Tác dụng với hiđro:
H2 + S → H2S (350oC)
Lưu huỳnh tác dụng với khí hiđro để tạo thành khí hiđro sunfua.
Tác dụng với kim loại (đặc biệt với kim loại có tính chất oxi hóa thấp và tạo ra sản phẩm có số oxi hóa thấp của kim loại).
(Ví dụ: trong quá trình thủy phân sunfua, phản ứng xảy ra ở nhiệt độ thường, do đó ta thường sử dụng lưu huỳnh để khử độc chất thủy ngân (Hg)).
Ngoài ra, lưu huỳnh còn có thể tác dụng với nhiều chất khác như… (vui lòng nhập thêm thông tin tại đây)
2. Lưu huỳnh có tính khử:
Trong hóa học, lưu huỳnh là một nguyên tố có tính chất khá đặc biệt. Khi lưu huỳnh tương tác với các phi kim hoạt động mạnh hơn, chúng ta có thể quan sát sự tăng số oxi hóa của lưu huỳnh từ 0 lên +4 hoặc +6.
Công thức diễn tả quá trình này như sau:
S → S+4 + 4e
S → S+6 + 6e
Điều này có nghĩa là lưu huỳnh có khả năng trao đổi electron với các phi kim và hợp chất có tính oxi hóa.
Ngoài ra, lưu huỳnh cũng có khả năng tương tác với oxi để tạo ra các sản phẩm mới. Ví dụ, khi lưu huỳnh tác dụng với axit sulfuric (H2SO4) hoặc axit nitric (HNO3), chúng ta có thể quan sát được hiện tượng tạo ra các chất mới như SO4^2- và NO3^-.
Tương tác này là một phản ứng hóa học quan trọng và được ứng dụng trong nhiều lĩnh vực khác nhau như công nghiệp, y học và nông nghiệp.
3. Câu hỏi vận dụng liên quan:
Câu 1. Trong phòng thí nghiệm người ta sử dụng phương pháp nào sau đây để điều chế khí sunfuro?
A. Đốt lưu huỳnh trong không khí
B. Cho sắt tác dụng với H2SO4 đặc nóng
C. Cho muối sunfit tác dụng với axit mạnh như HCl, H2SO4
D. Đốt cháy khí H2S trong không khí
Đáp án C
Trong phòng thí nghiệm, SO2 được điều chế bằng cách cho muối sunfit tác dụng với axit mạnh như HCl, H2SO4.
Ví dụ:
Na2SO3 + 2HCl → 2NaCl + H2O + SO2
Ngoài ra, khí SO2 còn được điều chế bằng cách cho Cu tác dụng với H2SO4 đặc.
Cu + 2H2SO4đặc → CuSO4 + SO2 + 2H2O
Khí SO2 được thu bằng phương pháp đẩy không khí.
Câu 2. Hơi thủy ngân rất độc và khó gom lại, khi làm vỡ nhiệt kế thủy ngân chúng ta thường dùng một chất bột rắc lên thủy ngân và gom lại. Chất bột đó là chất nào dưới đây?
A. Bột than.
B. Cát mịn.
C. Muối hạt.
D. Lưu huỳnh.
Đáp án D
Thủy ngân và lưu huỳnh có thể tương tác với nhau ngay tại điều kiện thường. Phản ứng giữa thủy ngân và lưu huỳnh được mô tả bởi công thức:
Hg + S → HgS ↓
Khi xảy ra phản ứng này, sản phẩm cuối cùng là chất lưu huỳnh (HgS) được tạo thành.
Khi một nhiệt kế chứa thủy ngân bị vỡ, chúng ta thường sử dụng một chất bột để rắc lên thuỷ ngân vỡ, sau đó gom lại chất bột đó. Điều này nhằm mục đích chứa kín và kiểm soát thủy ngân đã bị rò rỉ. Chất bột được sử dụng thường là lưu huỳnh, nhưng cũng có thể là các chất khác tương tự có khả năng tương tác với thủy ngân.
Vì lưu huỳnh có tính chất khá ổn định và ít độc hại, việc sử dụng nó để xử lý sự cố thủy ngân là một phương pháp an toàn và hiệu quả.
Câu 3. Ứng dụng nào sau đây không phải của lưu huỳnh?
A. Làm nguyên liệu sản xuất H2SO4 .
B. Làm chất lưu hóa cao su.
C. Khử chua đất.
D. Điều chế thuốc súng đen.
Đáp án C
Lưu huỳnh không chỉ không có tác dụng khử chua đất, mà còn có nhiều ứng dụng khác trong lĩnh vực hóa học và công nghệ. Một trong những ứng dụng phổ biến của lưu huỳnh là trong sản xuất phân bón, nơi nó được sử dụng để cung cấp nguồn dinh dưỡng cho cây trồng. Ngoài ra, lưu huỳnh cũng được sử dụng trong việc sản xuất thuốc trừ sâu, thuốc nhuộm và các sản phẩm khác trong ngành công nghiệp hóa chất. Do đó, lưu huỳnh không chỉ đóng vai trò là một chất khử chua đất mà còn có nhiều ứng dụng quan trọng khác.
Câu 4. Bạc để trong không khí lâu ngày sẽ có màu đen xám vì có xảy ra phản ứng:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O.
Phát biểu nào là đúng trong các phát biểu sau?
A. Ag là chất khử, O2 là chất oxi hóa
B. Ag là chất oxi hóa, H2S là chất khử
C. H2S là chất khử, O2 là chất oxi hóa
D. H2S là chất oxi hóa, Ag là chất khử
Đáp án A
Câu 5. Có thể dùng hóa chất nào sau đây để phân biệt khí H2S và SO2đựng trong hai lọ riêng biệt?
A. dung dịch FeSO4
B. dung dịch Br2
C. dung dịch KMnO4
D. dung dịch Ca(OH)2
Đáp án D
Sử dụng dung dịch Ba(OH)2 vì:
Ba(OH)2 + SO2 → BaSO3↓ + H2O
Ba(OH)2 + H2S → BaS(tan) + 2H2O
Câu 6. Tính chất vật lí nào sau đây không phải của lưu huỳnh
A. chất rắn màu vàng, giòn
B. không tan trong nước
C. có tnc thấp hơn ts của nước
D. tan nhiều trong benzen, ancol etylic
Đáp án C
Nhiệt độ nóng chảy của chất S là 115,21oC, một con số cao hơn so với nhiệt độ sôi của nước. Khi chất S được đun nóng đến nhiệt độ này, nó sẽ chuyển từ trạng thái rắn sang trạng thái lỏng. Điều này có ý nghĩa rằng chất S cần một lượng nhiệt lớn hơn nước để thay đổi từ trạng thái rắn sang trạng thái lỏng. Điều này cũng cho thấy tính chất đặc biệt của chất S trong việc chịu nhiệt.
Câu 7. Chỉ ra câu trả lời không đúng về khả năng phản ứng của S?
A. S vừa có tính oxi hoá vừa có tính khử.
B. Hg phản ứng với S ngay nhiệt độ thường.
C. Ở nhiệt độ thích hợp, S tác dụng với hầu hết các phi kim và thể hiện tính oxi hóa.
D. Ở nhiệt độ cao, S tác dụng với nhiều kim loại và thể hiện tính oxi hoá.
Đáp án C
Câu không chính xác là: Ở nhiệt độ thích hợp, S tác dụng với hầu hết các phi kim và có tính oxi hóa.
Thực tế, S không thể thể hiện tính oxi hóa khi tác dụng với hầu hết các phi kim. Sự phản ứng chính của S là khử oxi, không phải oxi hóa.
Khi S tác dụng với oxi, nó sẽ tạo thành hợp chất SO₂. Công thức phản ứng là: S + O₂ → SO₂. Đây là một ví dụ về phản ứng khử, trong đó S tác dụng với oxi để giảm một lượng oxi trong hợp chất SO₂.
Ngoài ra, S cũng có thể thể hiện tính khử với nhiều chất khác như các halogen (F, Cl, Br, I), oxit kim loại, và nhiều hợp chất oxi hóa khác.
Vì vậy, câu đúng sẽ là: Ở nhiệt độ thích hợp, S tác dụng với oxi và thể hiện tính khử, không phải tính oxi hóa. Ngoài ra, S cũng có khả năng khử nhiều chất khác trong các phản ứng hóa học.