Kim loại nào sau đây tác dụng với Cl2 và HCl tạo ra cùng một muối được chúng tôi biên soạn hướng dẫn bạn đọc trả lời câu hỏi liên quan đến kim loại nào sau đây khi tác dụng với HCl và tác dụng với Cl2 cho cùng một loại muối clorua. Mời các bạn cùng theo dõi bài viết dưới đây.
Mục lục bài viết
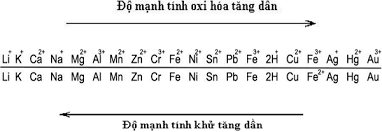
1. Kim loại nào tác dụng với Cl2 và HCl tạo ra cùng một muối:
Kim loại nào sau đây tác dụng với Cl2 và HCl tạo ra cùng một muối là
A. Fe
B. Mg
C. Cu
D. Ag
Đáp án chi tiết: B
Một số kim loại như Cu (Đồng) và Ag (Bạc) thường chỉ tác dụng được với Cl2. Ví dụ, khi Cu tác dụng với Cl2, phản ứng tạo ra muối CuCl2:
Tương tự, Ag cũng có thể tạo ra muối tương ứng với Cl2 theo phản ứng:
Ở đây, Cu và Ag đều tạo ra muối chlorua khi tương tác với Cl2, nhưng chúng không tạo muối khi phản ứng với HCl.
Trong khi đó, kim loại Fe (Sắt) có khả năng tác dụng cả với Cl2 và HCl. Khi Fe tương tác với Cl2, có thể tạo ra muối FeCl3:
Khi tương tác với HCl, Fe tạo muối FeCl2 theo phản ứng:
2
Ở đây, Fe tạo ra muối có cả valence state III (FeCl3) và valence state II (FeCl2) tùy thuộc vào chất tác động (Cl2 hoặc HCl).
Còn kim loại Mg (Magie), duy nhất trong nhóm này, có khả năng tác dụng với cả Cl2 và HCl tạo ra muối MgCl2. Khi Mg tương tác với Cl2, phản ứng có thể được biểu diễn như sau:
2
Khi tương tác với HCl, Mg cũng tạo muối MgCl2 theo phản ứng:
2
Như vậy, Mg là kim loại duy nhất trong danh sách này có khả năng tạo ra cùng một muối khi tương tác với cả Cl2 và HCl.
2. Tính chất hoá học của kim loại:
Kim loại là một nhóm chất vô cùng đa dạng và quan trọng trong thế giới hóa học. Tính chất hoá học của kim loại đóng vai trò quan trọng trong nhiều lĩnh vực, từ công nghiệp đến y học. Trong bài viết này, chúng ta sẽ khám phá những tính chất hoá học đặc sắc của kim loại và cách chúng tương tác với các chất khác.
– Tính chất Oxi hóa và khử: Kim loại thường có khả năng tương tác với oxi và có thể trải qua quá trình oxi hóa. Ví dụ, sắt (Fe) có thể oxi hóa để tạo ra oxit sắt () trong môi trường có oxi. Ngược lại, kim loại có thể tham gia vào các phản ứng khử, như việc magiê (Mg) tương tác với nước để tạo khí hiđrô và oxit magiê ().
– Tính chất điện hóa: Nhiều kim loại là tốt dẫn điện do khả năng chuyển động tự do của electron trong cấu trúc tinh thể của chúng. Điều này giúp chúng thường được sử dụng trong các ứng dụng điện hóa, như dẫn điện trong các mạch điện tử.
– Tính chất tương tác với axít và bazơ: Một số kim loại có khả năng tương tác với axít và bazơ để tạo muối. Ví dụ, kết hợp giữa sắt và axít clohidric (HCl) tạo ra muối sắt (II) (2) và kết hợp với axít clohidric mạnh hơn, ta có muối sắt (III) (). Điều này thể hiện tính chất đa dạng của kim loại trong các phản ứng hóa học.
– Tính chất dẫn nhiệt và dẫn điện: Nhiều kim loại có khả năng dẫn nhiệt và dẫn điện tốt, điều này làm cho chúng trở thành vật liệu lý tưởng trong sản xuất các dụng cụ và thiết bị điện tử.
– Tính chất hợp kim: Kim loại thường tạo hợp kim với nhau hoặc với phi kim để tạo ra những chất mới có tính chất khác biệt. Ví dụ, hợp kim đồng-niken (Cu-Ni) thường được sử dụng trong sản xuất các đồ vật gia dụng vì tính chất chống ăn mòn của chúng.
– Tính chất tương tác với nước: Một số kim loại phản ứng với nước, giải phóng khí hiđrô và tạo ra oxit kim loại. Ví dụ, kali (K) và natri (Na) là những kim loại có tính chất này.
Tính chất hoá học của kim loại là một chủ đề rộng lớn, đa dạng và thú vị. Sự hiểu biết về những tính chất này không chỉ làm phong phú kiến thức khoa học mà còn mở ra những ứng dụng rộng lớn trong nhiều lĩnh vực của cuộc sống. Kim loại, với tính chất đặc sắc của mình, đóng vai trò quan trọng trong sự phát triển của công nghiệp và khoa học hiện đại.
3. Các bài tập liên quan kèm đáp án:
Câu 1: Trong các kim loại sau: Mg, Al, Zn, Cu. Số kim loại đều tan trong dung dịch HCl và dung dịch H2SO4 đặc nguội:
A. 4
B. 3
C. 5
D. 2
Đáp án D
Câu 2: Kim loại nào sau đây tác dụng với dung dịch HCl loãng và khí Cl2 không cho cùng loại muối clorua kim loại nào?
A. Ag
B. Fe
C. Cu
D. Zn
Đáp án B
Câu 3: Kim loạ nào sau đây tác dụng với khí Cl2 nhưng không tác dụng với dung dịch HCl loãng?
A. Ag
B. Cu
C. Fe
D. Zn
Đáp án B
Kim loại tác dụng với HCl và với Cl2 cho cùng 1 loại muối clorua là Zn
Loại C vì Fe cho 2 loại muối
Loại A và D vì không phản ứng với HCl
Câu 4: Cho các chất sau: Fe(OH)3, Fe3O4, FeSO4 và Fe(NO3)2. Số chất trong dãy tác dụng với dung dịch HCl là
A. 2
B. 1
C. 3
D. 4
Đáp án: C
Các chất phản ứng với HCl là: Fe(OH)3, Fe3O4, Fe(NO3)2
Fe(OH)3 + 3H+ → Fe3+ + 3H2O
Fe3O4 + 8H+ → Fe2+ + 2Fe3+ + 4H2O
→ có 3 chất
Câu 5: Các kim loại chỉ tác dụng với dung dịch H2SO4 loãng mà không tác dụng với dung dịch H2SO4 đặc nguội là:
A. Fe và Al
B. Mg và Cu
C. Cu và Fe
D. Mg và Al
Đáp án: A. Các kim loại chỉ tác dụng với dung dịch H2SO4 loãng mà không tác dụng với dung dịch H2SO4 đặc nguội là Fe và Al (Fe và Al bị thụ động hoá trong H2SO4 đặc nguội)
Câu 6: Kim loại M phản ứng được với các dung dịch HCl, Cu(NO3)2, HNO3 (đặc, nguội). M là kim loại nào dưới đây
A. Ag
B. Al
C. Fe
D. Zn
Đáp án D
Câu 7: Ở điều kiện thường, kim loại Fe phản ứng được với dung dịch nào sau đây:
A. NaCl
B. FeCl3
C. ZnCl2
D. MgCl2
Đáp án B
Câu 8: Trong các kim loại Na; Ca; K; Al; Fe; Cu và Zn số kim loại tan tốt vào dung dịch KOH là
A. 3
B. 5
C. 6
D. 4
Đáp án B
Câu 9: Ở điều kiện thường, kim loại nào sau đây tác dụng mạnh với H2O
A. Fe
B. Cu
C. Mg
D. Ca
Đáp án D
Câu 10: Cho phản ứng hoá học: 4Cr + 3O2 -> 2Cr2O3 Trong phản ứng trên xảy ra
A. Sự khử Cr và sự oxi hoá O2
B. Sự khử Cr và sự khử O2
C. Sự oxi hoá Cr và sự khử O2
D. Sự oxi hoá Cr và sự oxi hoá O2
Đáp án C
Câu 11: Ở nhiệt độ thường , kim loại Na phản ứng với nước tạo thành
A. Na2O và H2
B. NaOH và O2
C. Na2O và O2
D. NaOH và H2
Đáp án: D
Câu 12: Tính chất hoá học đặc trưng của kim loại là
A. Tính khử
B. Tác dụng với axit
C. Tác dụng với phi kim
D. tác dụng oxi hoá
Đáp án: A
Câu 13: Ở điều kiện thường, kim loại nào sau đây không phản ứng với nước
A. Na
B. Be
C. K
D. Na
Đáp án B
Câu 14: Ở điều kiện thường, kim loại nào sau đây tác dụng mạnh với H2O
A. Cu
B. Mg
C. Fe
D. Ca
Đáp án: D
Câu 15: Ở điều kiện thường, kim loại nào sau đây không phản ứng với nước?
A. K
B. Cu
C. Al
D. Ca
Đáp án B
Câu 16: Dãy gồm các kim loại đều phản ứng với nước ở nhiệt độ thường tạo ra dung dịch có môi trường kiềm là:
A. Na, Cr, K
B. Be, Na, Ca
C. Na, Ba, K
D. Na, Fe, K
Đáp án C
Câu 17: Cho dãy các kim loại: Ag, Cu, Al, Mg. Kim loại trong dãy có tính khử yếu nhất là
A. Mg
B. Al
C. Ag
D. Cu
Đáp án C
Câu 18: Ở thí nghiệm nào sau đây Fe chỉ bị ăn mòn hoá học?
A. Đốt cháy dây sắt trong không khí khô
B. Cho hợp kim Fe – Cu vào dung dịch CuSO4
C. Để mẫu gang lâu ngày trong không khí ẩm
D. Cho Fe vào dung dịch AgNO3
Đáp án A.
Câu 19: Trong thực tế, không sử dụng các nào sau đây để bảo vệ kim loại sắt khỏi bị ăn mòn?
A. Gắn đồng với kim loại mắt
B. Tráng thiếc lên bề mặt sắt
C. Tráng kẽm lên bề mặt sắt
D. Phủ một lớp sơn lên bề mặt sắt
Đáp án A
Câu 20: Cho các hợp kim sau: Cu – Fe (1); Zn – Fe (2); Fe – C (3); Sn – Fe (4). Khi tiếp xúc với dung dịch chất điện li thì các hợp kim mà trong đó Fe đều bị ăn mòn trước là:
A. (1), (2) và (3)
B. (1), (3), và (4)
C. (1), (2) và (4)
D. (2), (3) và (4)
Đáp án A
Câu 21: Cho các hợp kim: Fe – Cu; Fe – C; Zn – Fe; Mg – Fe tiếp xúc với không khí ẩm. Số hợp kim trong đó Fe bị ăn mòn điện hoá là:
A. 4
B. 1
C. 2
D. 3
Đáp án C. Fe – Cu; Fe – C
Câu 22: Nguyên liệu chính để điều chế kim loại Na trong công nghiệp là:
A. NaCl
B. NaNO3
C. Na2CO3
D. NaOH
Đáp án A
Câu 23: Trong công nghiệp, Mg được điều chế bằng cách nào dưới dây
A. Cho kim loại Fe và dung dịch MgCl2
B. Điện phân dung dịch MgSO4
C. Điện phân nóng chảy MgCl2
D. Cho kim loại K vào dung dịch Mg(NO3)2
Đáp án B
Câu 24: Nguyên tắc làm mềm nước cứng là:
A. thay thế các ion Mg2+ và Ca2+ trong nước cứng bằng các ion khác
B. khử các ion Mg2+ và Ca2+ trong nước cứng
C. Làm giảm nồng độ các ion Mg2+ và Ca2+ trong nước cứng
D. oxi hoá các ion Mg2+ và Ca2+ trong nước cứng
Đáp án C
Câu 25: Phát biểu nào sau đây là đúng?
A. Ở điều kiện thường, các kim loại đều có khối lượng riêng lớn hơn khối lượng riêng của nước
B. Các kim loại đều chỉ có một số oxi hoá duy nhất trong các hợp chất
C. Ở điều kiện thường, tất cả các kim loại đều ở trạng thái rắn
D. Tính chất hoá học đặc trưng của kim loại là tính khử
Đáp án D
Câu 26: Nhận xét sau đây không đúng?
A. Các kim loại kiềm đều mềm và nhẹ
B. Các kim loại kiềm đều có nhiệt độ nóng chảy rất cao
C. Các kim loại kiềm đều có cấu hình electron lớp ngoài cùng là ns1
D. Các kim loại kiềm đều có tính khử mạnh
Chọn đáp án: B
Câu 27: Phát biểu nào sau đây là đúng?
A. Các kim loại kiềm có khối lượng riêng giảm dần từ Li đến Cs
B. Các kim loại kiềm có nhiệt độ nóng chảy giảm dần từ Li đến Cs
C. Các kim loại kiềm thổ có khối lượng riêng tăng dần từ Be đến Ba
D. Các kim loại kiềm thổ có nhiệt độ nóng chảy tăng dần từ Be đến Ba
Đáp án B
Câu 28: Nhận xét nào sau đây là sai?
A. Tính chất hoá học chung của kim loại là tính oxi hoá
B. Nguyên tử của hầu hết các nguyên tố kim loại đều có ít electron ở lớp ngoài cùng
C. Những tính chất vật lý chung của kim loại chủ yếu do các electeon tự do trong mạng tinh thể kim loại gây ra
D. Nguyên tắc điều chế kim loại là khử ion kim loại thành nguyên tử.
Đáp án A