Ancol là nhóm hợp chất hữu cơ có nhiều ứng dụng trong cuộc sống cũng như la nguyên liệu trong sản xuất công nghiệp. Vậy Ancol là gì? Công thức của ancol là gì? Ancol có đặc điểm tính chất lý hóa như thế nào? Cách phân biệt ancol bậc 1,2,3 ra sao? Cùng chúng tôi giải đáp những vấn đề này nhé.
Mục lục bài viết
1. Chất nào sau đây thuộc loại ancol bậc 1?
(CH3)3COH.
CH3CH(OH)CH2CH3.
CH3CH(OH)CH3.
CH3CH2OH.
Đáp án : D
Bậc của ancol chính là bậc của cacbon mà OH gắn trực tiếp vào đó
2. Ancol là gì?
Ancol hay còn được biết đến cái tên là rượu. Nó là một hợp chất hữu cơ chứa nhóm chức – OH được gắn với một nguyên tử cacbon no nhưng khi đến lượt nó lại gắn với một nguyên tử hydro hoặc cacbon khác.
2.1. Công thức của ancol:
Ancol có công thức tổng quát là:
CxHyOz ( Trong đó x, y, z thuộc N*; y chẵn và 4=< y =< 2x + 2, z =< x ): thường sử dụng khi viết phản ứng cháy.
CxHy(OH)z hoặc R(OH)z: thường dùng trong viết phản ứng xảy ra ở nhóm OH
CnH2n+2-2k-z(OH)z ( trong đó k là số liên kết pi + số vòng, còn n, z là các số tự nhiênn với z =< n ): thường sử dụng khi viết các phản ứng cộng H2, Br2 khi biết được số chức, no hay không no,..
2.2. Các bậc và phân loại ancol:
– Bậc của ancol là bậc của nguyên tử cacbon liên kết cùng nhóm – OH
– Phân loại:
Theo cấu trúc sẽ có ancol mạch thẳng và mạch nhánh, vòng
Nếu phân theo liên kết sẽ gồm loại no và loại không no
Phân loại theo chức có ancol đơn chức và loại đa chức.
2.3. Cách nhận biết ancol:
Khả năng tạo khí không màu với kim loại kiềm ( lưu ý phản ứng này đều xảy ra với mọi dung dịch )
Làm CuO đun nóng chuyển từ đen sang đỏ
Với loại đa chức có các nhóm -OH liền kề hòa tan Cu(OH)2 tạo ra dung dịch màu xanh
Ancol không no sẽ có phản ứng mất màu dung dịch Brom.
3. Các tính chất của ancol:
3.1. Phân loại:
– Ancol no, đơn chức và mạch hở
Phân tử ancol có một nhóm OH và liên kết gốc ankyl: CnH(2n+1)OH
Ví dụ: CH3 – OH, C3H7 – OH,…
– Ancol không no, đơn chức mạch hở
Phân tử ancol có một nhóm OH và liên kết với nguyên tử cacbon no của gốc hidrocacbon không no
Ví dụ: CH2 = CH – CH2 – OH, CH3 – CH = CH – CH2 – OH…
– Ancol thơm và đơn chức
Phân tử có nhóm OH và liên kết với nguyên tử cacbon no và sẽ thuộc mạch nhánh của vòng benzen
Ví dụ: C6H5 – CH2 – OH là ancol benzylic
– Ancol vòng no và đơn chức
Phân tử ancol có một nhóm OH để liên kết với nguyên tử cacbon no thuộc gốc hidrocacbon có vòng no.
Ví dụ: C6H11OH là xiclohexanol
– Ancol đa chức
Phân tử có từ hai hay nhiều nhóm OH
Ví dụ HO – CH2 – OH hay HO- CH2 – CH2OH – CH2 – OH
3.2. Đồng phân và danh pháp:
Đồng phân
Các ancol no, mạch hở, đơn chất sẽ có đồng phân mạch cacbon và đồng phân ở vị trí nhóm chức OH ( trong mạch cacbon )
Danh pháp
Tên thông thường
Ancol + tên gốc ankyl +ic
Tên thay thế
Là tên hidrocacbon tương ứng với mạch chính + với số chỉ vị trí nhóm OH + ol
| Số nguyên tử C | Công thức cấu tạo | Tên thông thường | Tên thay thế |
| 1 | CH3OH | Ancol metylic | Metanol |
| 2 | CH3CH3OH | Ancol etylic | Etanol |
| 3 | CH3CH2CH2OH | Ancol propylic | Propan – 1 – ol |
| 4 | CH3CH2CH2CH2OH | Ancol butylic | Butan – 1 – ol |
| 4 | CH3CH2CH(OH)CH3 | Ancol sec – butylic | Butan – 2 – ol |
| 4 | CH3CH(CH3)CH2OH | Ancol isobutylic | 2 – metylpropan – 1 – ol |
| 4 | (CH3)3C-OH | Ancol tert – butylic | 2 – metylpropan – 2 – ol |
3.3. Tính chất vật lý:
– Ở điều kiện thường chúng tồn tại dưới dạng chất lỏng hoặc rắn. Nhiệt độ sôi và khối lượng của các ancol sẽ tăng theo chiều tăng phân tử khối. Ngược lại, độ tan trong nước của chúng sẽ giảm đi khi phân tử khối tăng lên.
– Chúng có nhiệt độ sôi cao hơn so với các hidrocacbon có cùng phân tử khối hoặc đồng phân êt của nó do có sự liên kết hidro giữa các phân tử ancol
3.4. Tính chất hóa học:
Phản ứng cùng kim loại kiềm
Phản ứng của Na với ancol
R(OH)z + Na → R(ONa)z + z/2 H2
Hầu như không phản ứng cùng NaOH, ngược lại natri ancolat bị phân hủy hoàn toàn
R(ONa)z + z H2O → R(OH)z + z NaOH
Trong phản ứng của ancol cùng với Na
m bình Na tăng = m ( ancol) – m (H2) = n ( ancol) x ( Mr + 16z )
m bình ancol tăng = m ( Na ) – m ( H2 )= n (ancol) x 22z
Nếu cho dung dịch ancol phản ứng cùng Na thì ngoài phản ứng của ancol còn xảy ra phản ứng của H2O với Na.
Số nhóm chức của ancol = 2 x n ( H2 ) / n ( ancol )
Phản ứng với axit
Phản ứng với axit vô cơ HX
CnH2n+2-2k-z(OH )z + ( z + k ) HX → CnH2n + 2 – z X ( z + k )
Trong đó số nguyên tử X sẽ bằng tổng số nhóm H với số liên kết pi
Với axit hữu cơ
ROH + R’COOH ⇔ R’COOH + H2O
y R(OH)x + x R'( COOH )y ⇔ R’x ( COO)xyRy + xy H2O
Phản ứng tách nước
– Tách nước từ một phân tử ancol tạo anken của ancol no, đơn chức và mạch hở
CnH(2n +1)OH → CnH2n + H2O ( H2SO4 đặc và nhiệt độ lớn hơn 170°C )
Điều kiện là ancol tham gia phản ứng có Ha. Nếu là ancol no và đơn chức, mạch hở khôn tách nước tạo anken thì nó là loại không có Ha. Nếu một ancol tách nước tạo thành hỗn hợp nhiều anken thì đó là ancol bậc cao và có mạch C không đối xứng qua cacbon liên kết với nhóm OH.
Nhiều ancol tách nước tạo thành một anken thì sẽ xảy ra một số khả năng sau:
Có loại không tách nước
Các ancol tham gia phản ứng là đồng phân của nhau
Phản ứng tách nước đặc biệt:
CH2OH – CH2OH → CH3CHO + H2O
CH2OH – CHOH – CH2H → CH2 = CH – CHO + H2O
– Tách nước từ hai phân tử ancol tạo ete
ROH + ROH → ROR +H2O ( H2SO4 đặc, ở 140 °C )
– Lưu ý:
Từ n ancol khác nhau sẽ thu được n x ( n + 1 ) / 2 ete. Trong đó có n ete đối xứng
Nếu tách nước thu được những ete có số mol bằng nhau thì các ancol tham gia vào phản ứng cũng có số mol bằng nhau và n ( ancol ) = 2 x n ( ete ) = 2 x n (H2O) , n ( ancol ) = n (ete) + n ( H2O ) + n ( ancol dư ).
Phản ứng oxy hóa
– Oxy hóa hoàn toàn:
CxHyOz + ( x + y/4 – z/2 ) O2 → x CO2 + y/s H2O
Lưu ý:
Phản ứng đốt cháy của ancol có đặc điểm tương tự như phản ứng đốt cháy hidrocacbo tương ứng. Nếu đốt cháy ancol cho n ( H2O ) > n ( CO2 ) thì ancol được mang đi đốt cháy là ancol no và n ( ancol ) = n ( H2O ) – n ( CO2 ). Trong trườn hợp hợp chất đốt cháy ancol cho n ( H2O ) > 1,5 x n ( CO2 ) thì ancol sẽ là CH3OH. Chỉ có H4 cùng CH3OH có tính chất này ( không kể amin ).
Khi thực hiện đốt cháy chất hữu cơ X thấy n ( H2O ) > n ( CO2 ) chất đó là ankan, ancol no, mạch hở hoặc là ete no mạch hở ( có cùng công thức là CnH( 2n + 2 )O4 )
– Với trường hợp oxi hóa không hoàn toàn
Ancol bậc I phản ứng với CuO tạo andehit
RCH2OH + CuRCHO + Cu + H20
Ancol bậc II phản ứng với Cuo tạo xeton:
RCHOHR + CuO – RCOR’ + Cu + H2O
Ancol bậc III không bị oxy hóa CuO
Lưu ý:
m ( chất rắn giảm ) = m ( Cuo phản ứng ) – m ( Cu tạo thành ) = 16 x n ( ancol đơn chức ).
4. Cách phân biệt ancol bậc I, bậc II, bậc III:
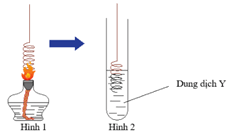
Ta có thể phân biệt bậc của ancol bằng cách oxi hóa ancol trong ống đựng CuO đun nóng sau đó nghiên cứu sản phẩm.
– Nếu sản phẩm tạo ra là anđehit: ancol ban đầu là bậc I
– Nếu sản phẩm tạo ra là xeton: ancol bậc II.
– Nếu ancol không bị oxi hóa: ancol bậc III.
* Phân biệt ancol bậc I:
– Để phân biệt ancol bậc I ta cho ancol tác dụng với CuO (đun nóng). Sau phản ứng màu đen của CuO sẽ chuyển sang màu đỏ của Cu. Sản phẩm tạo thành tác dụng với dung dịch AgNO3/NH3 tạo kết tủa trắng bạc
– Tổng quát:
(1) RCH2OH + CuO ![]() RCHO (anđehit) + H2O + Cu
RCHO (anđehit) + H2O + Cu
(2) RCHO + 2AgNO3 + 3NH3 + H2O![]() RCOONH4 + 2Ag↓ + 2NH4NO3
RCOONH4 + 2Ag↓ + 2NH4NO3
– Hiện tượng:
Phản ứng (1): CuO màu đen chuyển dần thành màu đỏ của Cu.
Phản ứng (2): Xuất hiện lớp bạc sáng như gương bám vào thành ống nghiệm.
– Ví dụ minh họa:
(1) CH3CH2OH + CuO ![]() CH3CH=O + H2O + Cu
CH3CH=O + H2O + Cu
CH3-CHO + 2AgNO3 + 3NH3 + H2O![]() CH3-COONH4 + 2Ag↓ + 2NH4NO3
CH3-COONH4 + 2Ag↓ + 2NH4NO3
* Phân biệt ancol bậc II:
– Để phân biệt ancol bậc II ta cho ancol tác dụng với CuO (đun nóng). Sau phản ứng màu đen của CuO sẽ chuyển sang màu đỏ.
Sản phẩm tạo thành khôngcó phản ứng tráng gương.
– Tổng quát:
R1CH(OH)R2 + CuO ![]() R1COR2 (xeton) + Cu + H2O
R1COR2 (xeton) + Cu + H2O
– Hiện tượng:
CuO màu đen chuyển dần thành màu đỏ của Cu.
– Phương trình hóa học minh họa:
CH3CH(OH)C2H5 + CuO ![]() CH3-CO-CH3 + Cu + H2O
CH3-CO-CH3 + Cu + H2O
* Phân biệt ancol bậc III:
Ancol bậc III không có phản ứng với CuO như trên.
THAM KHẢO THÊM: