Mục lục bài viết
- 1 1. Phương trình phản ứng Ca(HCO3)2 tác dụng với Ca(OH)2 :
- 2 2. Hiện tượng của phản ứng Ca(HCO3)2 tác dụng với Ca(OH)2:
- 3 3. Cách tiến hành phản ứng Ca(HCO3)2 tác dụng với Ca(OH)2:
- 4 4. Cách viết phương trình ion thu gọn của phản ứng Ca(HCO3)2 tác dụng với Ca(OH)2:
- 5 5. Mở rộng về phản ứng trao đổi trong dung dịch chất điện li:
- 6 6. Mở rộng kiến thức về muối cacbonat:
- 7 7. Bài tập vận dụng liên quan:
1. Phương trình phản ứng Ca(HCO3)2 tác dụng với Ca(OH)2 :
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
Phản ứng này thuộc loại phản ứng trao đổi.
2. Hiện tượng của phản ứng Ca(HCO3)2 tác dụng với Ca(OH)2:
– Canxi hiđrocacbonat phản ứng với canxi hiđroxit tạo thành kết tủa trắng canxi cacbonat
3. Cách tiến hành phản ứng Ca(HCO3)2 tác dụng với Ca(OH)2:
– Cho Ca(HCO3)2 tác dụng với Ca(OH)2
4. Cách viết phương trình ion thu gọn của phản ứng Ca(HCO3)2 tác dụng với Ca(OH)2:
Bước 1: Viết phương trình phân tử:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
Bước 2: Viết phương trình ion đầy đủ bằng cách: chuyển các chất vừa dễ tan, vừa điện li mạnh thành ion; các chất điện li yếu, chất kết tủa, chất khí để nguyên dưới dạng phân tử:
Ca2+ + 2HCO3– + Ca2+ + 2OH– → 2CaCO3↓ + 2H2O
Bước 3: Viết phương trình ion thu gọn từ phương trình ion đầy đủ bằng cách lược bỏ đi các ion giống nhau ở cả hai vế:
Ca2+ + HCO3– + OH– → CaCO3 + H2O
5. Mở rộng về phản ứng trao đổi trong dung dịch chất điện li:
Xét phản ứng:
Dung dịch A + dung dịch B → Sản phẩm.
– Phản ứng xảy ra trong dung dịch các chất điện li là phản ứng giữa các ion.
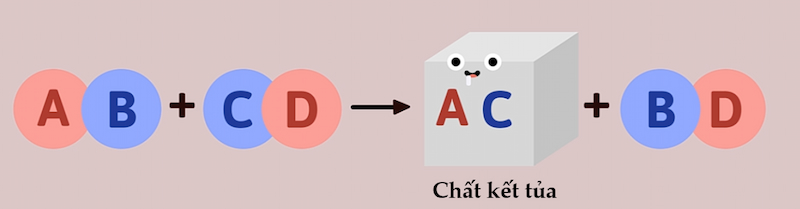
– Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất 1 trong số các chất sau:
+ Chất kết tủa.
+ Chất điện li yếu.
+ Chất khí.
Thí dụ:
+ Phản ứng tạo thành chất kết tủa:
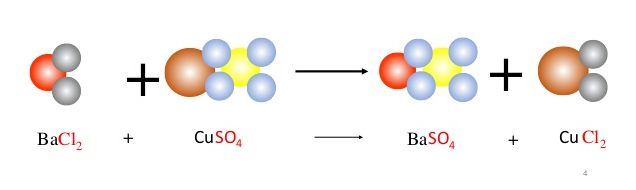
K2SO4 + BaCl2 → 2KCl + BaSO4↓
+ Phản ứng tạo thành chất điện li yếu:
HCl + KOH → KCl + H2O
+ Phản ứng tạo thành chất khí:
Fe + H2SO4 loãng → FeSO4 + H2↑
6. Mở rộng kiến thức về muối cacbonat:
Muối cacbonat là muối của axit cacbonic (gồm muối ![]() và
và ![]() ).
).
Tính tan:
– Muối cacbonat của các kim loại kiềm, amoni và đa số muối hiđrocacbonat dễ tan trong nước.
– Muối cacbonat của kim loại khác thì không tan.
Tính chất hóa học:
a) Tác dụng với axit
Thí dụ:
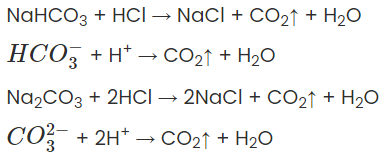
b) Tác dụng với dung dịch kiềm
– Các muối hiđrocacbonat tác dụng dễ dàng với dung dịch kiềm.
Thí dụ:
NaHCO3 + NaOH → Na2CO3 + H2O
HCO3−+OH−→CO32−+H2O”>![]()
c) Phản ứng nhiệt phân
– Muối cacbonat tan không bị nhiệt phân (trừ muối amoni), muối cacbonat không tan bị nhiệt phân:
![]()
– Tất cả các muối hiđrocacbonat đều bị nhiệt phân:
2NaHCO3 → Na2CO3 + CO2↑ + H2O
Ca(HCO3)2 → CaCO3 + H2O + CO2↑
Ứng dụng:
– Canxi cacbonat (CaCO3) tinh khiết là chất bột nhẹ, màu trắng, dùng làm chất độn trong cao su và 1 số ngành công nghiệp.
– Natri cacbonat (Na2CO3) khan (sođa khan) là chất bột màu trắng, tan nhiều trong nước. Dùng trong công ngiệp thủy tinh, đồ gốm, bột giặt, …
– Natri hiđrocacbonat (NaHCO3) là chất tinh thể màu trắng, hơi ít tan trong nước; dùng trong công nghiệp thực phẩm, trong y học dùng làm thuốc giảm đau dạ dày.
7. Bài tập vận dụng liên quan:
Câu 1: Cặp chất nào sau đây không bị nhiệt phân?
A. CaCO3, BaCO3.
B. Ca(HCO3)2, Ba(HCO3)2.
C. Na2CO3, K2CO3.
D. NaHCO3, KHCO3.
Hướng dẫn giải:
Đáp án C
Muối cacbonat của kim loại kiềm bền với nhiệt.
Câu 2: Hấp thụ hoàn toàn 0,16 mol CO2 vào 2 lít dung dịch Ca(OH)2 0,05M được kết tủa X và dung dịch Y. Khi đó khối lượng dung dịch Y so với khối lượng dung dịch Ca(OH)2 ban đầu sẽ là:
A. tăng 3,04g.
B. tăng 7,04g.
C. giảm 3,04g.
D. giảm 7,04g.
Hướng dẫn giải:
Đáp án A
nCO2=0,16 mol; nCa(OH)2=0,1 mol→1
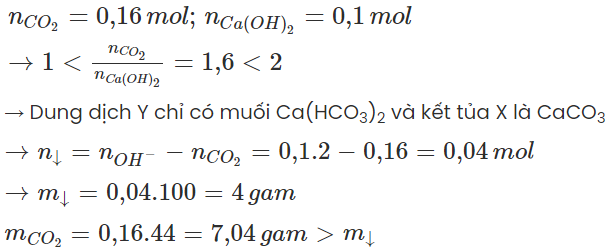
→ Dung dịch sau phản ứng tăng 3,04 gam.
Câu 3: Hình vẽ sau đây mô tả thí nghiệm điều chế và thu khí Y từ hỗn hợp rắn gồm CaCO3 và CaSO3:
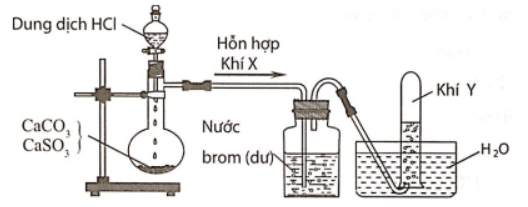
Khí Y là
A. CO2.
B. SO2.
C. H2.
D. Cl2.
Hướng dẫn giải:
Đáp án A
Hỗn hợp khí X gồm CO2 và SO2. Khí SO2 khi đi qua bình đựng nước brom đã bị giữ lại, còn khí Y thoát ra là CO2.
CaCO3→t0CaO+CO2″>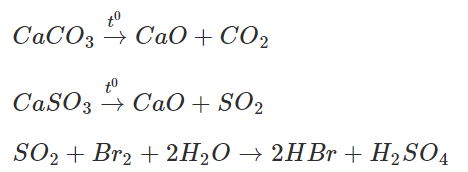
Câu 4: Nung 13,4g hỗn hợp muối cacbonat của hai kim loại hóa trị II. Sau khi phản ứng xảy ra hoàn toàn thu được 6,8g chất rắn và khí X. Lượng khí X sinh ra cho hấp thụ vào 75 ml dung dịch NaOH 1M. Khối lượng muối khan thu được sau phản ứng là:
A. 4,2g.
B. 5,8g.
C. 6,3g.
D. 6,5g.
Hướng dẫn giải:
Đáp án C
Gọi công thức chung của hai muối cacbonat là RCO3.
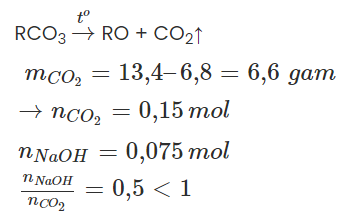
→ Tạo muối axit, NaOH hết.
CO2 + NaOH → NaHCO3
→ nmuối = nNaOH = 0,075 mol
→ mmuối = 0,075.84 = 6,3 gam
Câu 5: Để tạo xốp cho một số loại bánh, có thể dùng muối nào sau đây?
A. (NH4)3PO4.
B. NH4HCO3.
C. CaCO3.
D. NaCl.
Hướng dẫn giải:
Đáp án B
![]()
Khi sử dụng bột nở này, khí NH3 và CO2 thoát ra làm cho bánh căng phồng và xốp.
Câu 6: Tro thực vật được sử dụng như một loại phân bón cung cấp nguyên tố kali cho cây trồng do chứa muối kali cacbonat. Công thức của kali cacbonat là
A. KCl.
B. KOH.
C. NaCl
D. K2CO3
Hướng dẫn giải:
Đáp án D
Công thức của kali cacbonat là K2CO3.
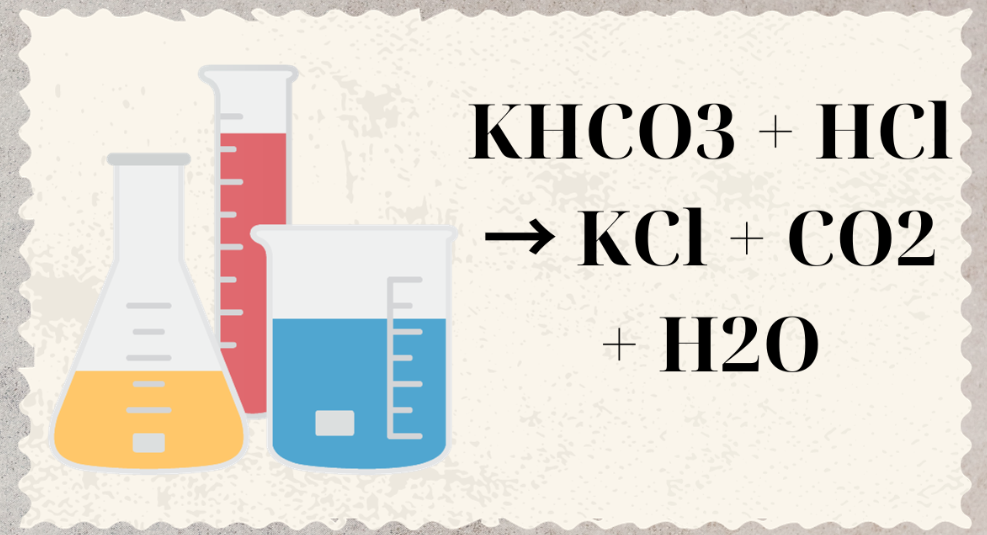
Câu 7: Chất nào sau đây tác dụng với dung dịch NaHCO3 sinh ra khí CO2?
A. NaCl.
B. KNO3.
C. KCl.
D. HCl.
Hướng dẫn giải:
Đáp án D
HCl + NaHCO3 → CO2↑ + NaCl + H2O
Câu 8: Cho 10 gam CaCO3 vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được V lít CO2 (đktc). Giá trị của V là
A. 2,80.
B. 2,24.
C. 1,12.
D. 3,36.
Hướng dẫn giải:
Đáp án B
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Bảo toàn nguyên tố C ta có:
nCO2=nCaCO3=10100=0,1 mol”>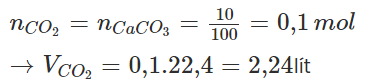
Câu 9: Natri cacbonat là hóa chất quan trọng trong công nghiệp thủy tinh, bột giặt, phẩm nhuộm, giấy, sợi. Công thức của natri cacbonat là
A. Na2CO3.
B. NaHCO3.
C. MgCO3.
D. CaCO3.
Hướng dẫn giải:
Đáp án A
Công thức của natri cacbonat là Na2CO3.
Câu 10: Nung CaCO3 ở nhiệt độ cao, thu được chất khí X. Chất X là
A. CaO.
B. H2.
C. CO.
D. CO2.
Hướng dẫn giải:
Đáp án D
Khí X là CO2:
![]()
Câu 11: Nghiên cứu về cách sử dụng muối cacbonat trong sản xuất vật liệu xây dựng, ngành thực phẩm, ngành dược phẩm, và trong công nghiệp chế biến.
Lời giải chi tiết:
Sản xuất vật liệu xây dựng:
Trong ngành xây dựng, muối cacbonat canxi (vôi) được sử dụng rộng rãi để sản xuất xi măng, chất làm trắng, vữa, vôi trắng, gạch, và sơn.
Ngành thực phẩm:
Trong ngành thực phẩm, muối cacbonat canxi thường được sử dụng như chất điều chỉnh độ pH, chất chống đông cứng cho sản phẩm thực phẩm như sữa chua, bia, nước ngọt, và trong việc chế biến các loại rau củ quả.
Ngành dược phẩm:
Trong ngành dược phẩm, muối cacbonat canxi có thể được sử dụng như một nguồn canxi trong các sản phẩm bổ sung canxi hoặc vitamin.
Công nghiệp chế biến:
Trong công nghiệp chế biến, muối cacbonat canxi được sử dụng làm nguyên liệu trong sản xuất giấy, cao su, nhựa, thuốc nhuộm, và trong quá trình sản xuất acid citric, natri cacbonat, và axit oxalic.
Việc sử dụng muối cacbonat canxi trong các ngành công nghiệp này thường liên quan đến tính chất vật lý và hóa học của nó, bao gồm khả năng tạo thành phản ứng hóa học, tác động đến cấu trúc và đặc tính của sản phẩm cuối cùng, và khả năng ổn định trong quá trình sản xuất. Sử dụng muối cacbonat cũng thường phụ thuộc vào nguồn cung cấp, giá cả và yêu cầu chất lượng trong từng ngành công nghiệp khác nhau.
Câu 12: Nghiên cứu về ảnh hưởng của muối cacbonat đến môi trường và sức khỏe, bao gồm tác động của nó đối với nước mưa axit và ảnh hưởng đến sức khỏe của cơ thể khi uống nước chứa nhiều muối cacbonat.
Lời giải chi tiết:
Muối cacbonat, đặc biệt là cacbonat canxi (CaCO3), có thể ảnh hưởng đến môi trường và sức khỏe con người trong một số trường hợp cụ thể:
Tác động của muối cacbonat đối với nước mưa axit:
– Nước mưa axit có thể hình thành khi các khí ô nhiễm như SO2 (có nguồn gốc từ khói, xe cộ hoặc nhà máy) hoặc NOx (có nguồn gốc từ xe cộ, đốt cháy nhiên liệu) hòa tan trong nước ở không khí, tạo thành axit sulfuric (H2SO4) hoặc axit nitric (HNO3).
– Muối cacbonat, như CaCO3, có thể được sử dụng để trung hòa axit trong nước mưa, giảm độ axit và làm giảm tác động của nước mưa axit đối với môi trường, đặc biệt là đối với sự ảnh hưởng tiêu cực đến hệ thống sinh thái nước.
Ảnh hưởng đến sức khỏe khi uống nước chứa nhiều muối cacbonat:
– Muối cacbonat có thể gây tăng độ cứng của nước. Mặc dù không có hại cho sức khỏe, nước có độ cứng cao có thể gây ra hiện tượng cặn cáp trong ống nước và thiết bị gia đình, cũng như làm giảm hiệu suất của các thiết bị sử dụng nước như máy rửa chén, máy giặt, và lò sưởi nước.
Một số người có thể không chịu nổi nước cứng và có thể phải sử dụng máy lọc nước hoặc các phương pháp xử lý nước để loại bỏ hoặc giảm độ cứng của nước.
Tuy nhiên, muối cacbonat không phải là chất độc hại đối với sức khỏe nếu được tiêu thụ theo liều lượng an toàn. Tuy nhiên, việc tiếp xúc với muối cacbonat ở dạng bụi hoặc hơi có thể gây kích ứng đường hô hấp và mắt.
THAM KHẢO THÊM: