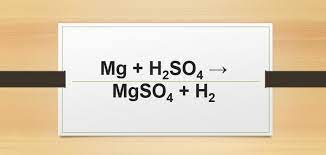
Zn + H2SO4 → ZnSO4 + H2 được chúng tôi biên soạn hướng dẫn các bạn viết và cân bằng phương trình phản ứng kim loại tác dụng với dung dịch axit, cụ thể ở đây à phương trình phản ứng Zn tác dụng với H2SO4 loãng.
Mục lục bài viết
1. Trình cân bằng phản ứng: Zn + H2SO4 → ZnSO4 + H2:
– Cho một ít kim loại Zn vào đáy ống nghiệm, thêm vào ống 1-2 ml dung dịch axit → Chất rắn màu xám sẫm Kẽm (Zn) tan dần và xuất hiện khí Hidro (H2) làm sủi bọt khí
– Loại phản ứng
+ Phản ứng đơn (Thế)
+ Phản ứng oxi-hoá khử
+ Phản ứng thế
– Chất phản ứng:
+ Kẽm – Zn: Zn Khối lượng mol Zn Số oxy hóa
+ Axít Sunfuric – H2SO4
Sản phẩm: Kẽm Sulfat – ZnSO4. ZnSO4 Khối lượng mol ZnSO4 Số oxy hóa. Triti – H2.
2. Tìm hiểu về Kẽm (Zn):
* Tổng quan:
Kẽm là một nguyên tố hoá học quan trọng, có số nguyên tử là 30 và được biểu diễn trong bảng hệ thống phần tử với ký hiệu Zn. Đây là một kim loại có màu trắng bạc, có độ bền và tính ổn định cao, do đó được sử dụng rộng rãi trong nhiều ứng dụng khác nhau từ công nghiệp đến y học.
Một trong những đặc điểm quan trọng của kẽm đó là khả năng chống ăn mòn. Kẽm có khả năng tạo ra lớp oxide bảo vệ tự nhiên khi tiếp xúc với không khí, ngăn chặn quá trình ăn mòn của kim loại bên trong. Điều này làm cho kẽm trở thành một vật liệu lý tưởng cho việc sử dụng trong việc phủ lớp bảo vệ cho các vật liệu khác, đặc biệt trong ngành sản xuất ô tô và xây dựng.
Ngoài ra, kẽm còn được sử dụng rộng rãi trong việc sản xuất pin, đặc biệt là pin điện hóa như pin AA và AAA. Sự hiện diện của kẽm trong các loại pin này giúp tăng hiệu suất và tuổi thọ của chúng. Điều này đã đóng vai trò quan trọng trong việc phát triển nguồn năng lượng di động và tiết kiệm năng lượng.
Chất hoá học của kẽm cũng được sử dụng trong việc sản xuất nhiều loại hợp kim. Kẽm thường được hòa tan và hòa trộn với các kim loại khác như đồng, nhôm và magiê để tạo ra các loại hợp kim có đặc tính cơ học và hóa học đặc biệt. Ví dụ, hợp kim kẽm-alumini (ZA) được sử dụng rộng rãi trong ngành công nghiệp để sản xuất các linh kiện máy móc nhờ tính dẻo và chịu nhiệt tốt của nó.
Cũng đáng lưu ý là kẽm còn có vai trò quan trọng trong sinh học và y học. Nó là một thành phần chính trong nhiều enzyme, đóng vai trò quan trọng trong quá trình trao đổi chất trong cơ thể. Ngoài ra, kẽm cũng được sử dụng trong nhiều loại thuốc và sản phẩm y tế khác nhau, từ việc điều trị mụn trứng cá đến hỗ trợ sức khỏe tóc và da.
Trong tự nhiên, kẽm không thường được tìm thấy dưới dạng nguyên tố tinh khiết mà thường tồn tại dưới dạng các khoáng chất trong đất đá hoặc các khoáng sản. Việc khai thác và chế biến kẽm đòi hỏi các công nghệ chế tạo và xử lý phức tạp để trích xuất và tinh lọc nguyên tố này.
Tóm lại, kẽm không chỉ là một chất hoá học quan trọng với nhiều ứng dụng rộng rãi trong công nghiệp và y học, mà còn đóng vai trò quan trọng trong cuộc sống hàng ngày của chúng ta thông qua nhiều sản phẩm và ứng dụng khác nhau. Độ bền, tính ổn định và khả năng tương tác với các chất khác là những đặc tính quan trọng đã làm cho kẽm trở thành một nguyên tố quan trọng không thể thiếu trong nhiều lĩnh vực khác nhau.
* Tính chất vật lí:
Kẽm là một kim loại có tính chất vật lý và cơ học đặc biệt, đóng vai trò quan trọng trong nhiều ứng dụng và ngành công nghiệp khác nhau. Tính chất vật lý của kẽm đặc biệt được biểu hiện qua nhiều đặc điểm đáng chú ý.
Đầu tiên, kẽm là một kim loại mềm, có thể uốn cong dễ dàng mà không bị gãy. Điều này làm cho kẽm trở thành một nguyên liệu lý tưởng cho việc sản xuất các tấm kim loại mỏng được sử dụng trong việc phủ lớp bảo vệ cho các vật liệu khác. Sự mềm dẻo của nó cũng làm cho kẽm trở thành một vật liệu được ưa chuộng trong việc tạo hình và gia công trong ngành công nghiệp chế tạo.
Mặc dù kẽm có tính chất mềm, nhưng nó cũng có độ bền cao và khả năng chịu tải tốt. Kim loại này có khả năng chịu nhiệt tốt, không bị dễ dàng biến dạng hay nứt khi tiếp xúc với các điều kiện nhiệt độ cực đoan. Do đó, kẽm thường được sử dụng trong việc sản xuất các vật liệu xây dựng, như tấm lợp kẽm, để bảo vệ nhà cửa khỏi thời tiết và ẩm ướt.
Tính chất vật lý đáng chú ý khác của kẽm là khả năng dẫn điện và dẫn nhiệt tốt. Điều này làm cho kẽm được ứng dụng rộng rãi trong các ngành công nghiệp điện tử và điện lạnh. Sự dẫn điện và dẫn nhiệt tốt của nó làm cho kẽm trở thành một vật liệu lý tưởng cho việc sản xuất các linh kiện điện tử và các thiết bị làm lạnh.
Ngoài ra, kẽm còn có khả năng chống ăn mòn tốt. Khi tiếp xúc với không khí, kẽm tạo ra một lớp oxide bảo vệ tự nhiên trên bề mặt của nó, ngăn chặn quá trình ăn mòn của kim loại bên trong. Điều này làm cho kẽm trở thành vật liệu lý tưởng cho việc sử dụng trong sản xuất các lớp phủ bảo vệ, ví dụ như việc phủ kẽm trên thép để ngăn chặn sự ăn mòn.
Tính chất vật lý đa dạng của kẽm đã tạo ra nhiều cơ hội và ứng dụng trong các ngành công nghiệp khác nhau, từ xây dựng đến công nghiệp điện tử và y học. Sự kết hợp giữa độ bền, dẫn điện, khả năng chống ăn mòn và tính mềm dẻo đã làm cho kẽm trở thành một nguyên liệu quan trọng và đa dạng trong thế giới hiện đại.
* Tính chất hoá học:
3. Tìm hiểu về sulfuric acid (H2SO4):
* Tổng quan:
H2SO4, hay còn được gọi là axit sulfuric, là một trong những hợp chất hóa học quan trọng và phổ biến nhất trong ngành công nghiệp hóa chất. Đây là một axit mạnh có công thức hóa học là H2SO4, được tạo thành từ hai nguyên tử hydro (H), một nguyên tử lưu huỳnh (S) và bốn nguyên tử oxy (O).
Axit sulfuric thường được sản xuất công nghiệp thông qua quá trình quan trọng gọi là quá trình Contact, trong đó sulfur dioxide (SO2) được oxi hóa để tạo thành khí sunfuric (SO3), sau đó khí này hấp thụ vào nước để tạo thành axit sulfuric. Trong tự nhiên, axit sulfuric cũng có thể được tạo ra thông qua quá trình tự nhiên nhưng ở mức độ rất ít và thường xuất hiện trong các môi trường như dung dịch nước mưa, còn được gọi là mưa axit.
Tính chất axit mạnh của H2SO4 làm cho nó trở thành một trong những chất hóa học quan trọng nhất trong các ứng dụng công nghiệp và trong cuộc sống hàng ngày. Nó được sử dụng trong sản xuất pin axit chì, phân bón, thuốc nhuộm, chất làm lạnh, và nhiều ứng dụng khác. Ngoài ra, axit sulfuric còn được sử dụng trong quá trình tạo ra các chất đẩy trong ngành công nghiệp không gian, trong xử lý nước và trong việc sản xuất các chất tẩy rửa mạnh.
Tuy nhiên, việc sử dụng axit sulfuric cần phải được thực hiện cẩn thận vì tính ăn mòn cao của nó. Nó có thể gây ra tác động tiêu cực đến da, môi trường và cơ sở hạ tầng nếu không được sử dụng đúng cách hoặc xử lý một cách an toàn.
Nhìn chung, axit sulfuric không chỉ là một hợp chất hóa học quan trọng trong ngành công nghiệp mà còn đóng vai trò quan trọng trong nhiều khía cạnh của cuộc sống hàng ngày. Sự hiện diện và ứng dụng rộng rãi của nó đòi hỏi sự chú ý đến cách sử dụng và xử lý an toàn để đảm bảo rằng nó được tận dụng một cách hiệu quả mà không gây hậu quả đáng tiếc.
* Tính chất vật lí:
Axit sulfuric (H2SO4) là một chất lỏng không màu, không mùi và có độ nhớt cao. Dưới điều kiện tiêu chuẩn, nó có mật độ cao và có khả năng hòa tan mạnh các chất khác, đặc biệt là các chất hữu cơ và khoáng chất.
Điểm nóng chảy của axit sulfuric là khoảng 10-12°C (50-54°F), tùy thuộc vào độ tinh khiết của nó. Khi tinh khiết, axit sulfuric có thể tạo ra một lớp đáy đặc ở nhiệt độ dưới điểm nóng chảy này. Điều này có thể khiến việc làm lạnh hoặc lưu trữ axit sulfuric ở nhiệt độ thấp trở nên phức tạp hơn.
Nhiệt độ sôi của axit sulfuric tùy thuộc vào độ tinh khiết và có thể dao động từ khoảng 290°C (554°F) đến 340°C (644°F). Đây là một nhiệt độ cao, đòi hỏi sự chú ý đặc biệt khi làm việc với axit này, đặc biệt là trong các ứng dụng công nghiệp.
Ngoài ra, axit sulfuric cũng có khả năng hút ẩm mạnh. Điều này có thể dẫn đến việc nó hấp thụ nước từ không khí, biến đổi từ dạng đặc thành dạng dung dịch nước trong không khí ẩm.
Tính chất vật lý của axit sulfuric quyết định rất nhiều về cách xử lý, lưu trữ và sử dụng nó trong các quá trình công nghiệp và các ứng dụng khác. Sự chú ý đặc biệt cần được dành cho việc xử lý an toàn và lưu trữ axit sulfuric để tránh tai nạn và đảm bảo an toàn cho môi trường cũng như người sử dụng.
* Tính chất hoá học:
Axit sulfuric (H2SO4) là một trong những axit mạnh và quan trọng nhất trong hóa học với nhiều tính chất hoá học đặc trưng:
– Tính oxi hóa: Axit sulfuric có khả năng oxi hóa mạnh mẽ. Nó có thể tác động lên các chất khác, tạo ra các phản ứng oxi hóa. Ví dụ, nó có thể oxi hóa các chất hữu cơ, gây ra các phản ứng cháy hoặc thay đổi cấu trúc hóa học của chúng.
– Tính khử: Mặc dù axit sulfuric là một chất oxi hóa mạnh, nhưng nó cũng có thể tham gia vào các phản ứng khử. Điều này đặc biệt quan trọng trong quá trình sản xuất một số hợp chất hóa học khác.
– Tính chất proton: Axit sulfuric cung cấp proton (H+) khi tan trong nước, tạo ra môi trường axit mạnh. Điều này làm cho nó trở thành một chất axit đặc trưng và có khả năng phản ứng với các chất cơ bản (base) để tạo thành muối và nước.
– Tính chất hòa tan: Axit sulfuric có khả năng hòa tan mạnh đối với nhiều loại chất, đặc biệt là kim loại và các hợp chất hữu cơ. Quá trình hòa tan này thường đi kèm với việc tạo ra nhiệt và có thể tạo ra phản ứng hoặc thay đổi cấu trúc của các chất tham gia.
– Tính ăn mòn: Axit sulfuric làm ăn mòn các vật liệu như kim loại và các vật liệu không kim loại. Nó có khả năng phá hủy cấu trúc của chúng qua quá trình oxi hóa hoặc phản ứng với các phần tử trong chúng.
– Tính tạo muối: Khi axit sulfuric phản ứng với các base, nó tạo ra muối và nước.
Tính chất hoá học đặc trưng của axit sulfuric đã làm cho nó trở thành một trong những hợp chất hóa học quan trọng nhất và có nhiều ứng dụng rộng rãi trong ngành công nghiệp, từ sản xuất phân bón đến pin axit, từ sản xuất dược phẩm đến công nghệ xử lý nước và nhiều lĩnh vực khác. Tuy nhiên, tính chất ăn mòn và mạnh mẽ của nó cũng yêu cầu sự cẩn trọng khi sử dụng và xử lý để tránh tai nạn và hậu quả không mong muốn.