Phản ứng điện phân nóng chảy Al2O3 ra Al thuộc loại phản ứng phân hủy, phản ứng oxi hóa khử. Dưới đây là các kiến thức cùng một số bài tập có liên quan về Phương trình điện phân nóng chảy: Al2O3 → Al + O2 có lời giải. Mời các bạn đón xem.
Mục lục bài viết
1. Phương trình điện phân nóng chảy: Al2O3 → Al + O2:
Phương trình điện phân nóng chảy Al2O3 để sản xuất nhôm và khí oxi là một quá trình quan trọng trong ngành công nghiệp nhôm. Quá trình này bao gồm việc nung chảy oxit nhôm (Al2O3) thường được tìm thấy trong quặng bauxite, và sau đó sử dụng dòng điện để phân tách oxit nhôm thành nhôm kim loại (Al) và khí oxi (O2). Điều này được thực hiện trong một lò điện phân, nơi oxit nhôm được hòa tan trong một chất điện ly nóng chảy, thường là cryolite (Na3AlF6), để giảm điểm nóng chảy của oxit nhôm và tăng hiệu quả của quá trình điện phân.
Khi dòng điện một chiều được áp dụng qua lò, ion nhôm (Al3+) và ion oxi (O2-) trong hỗn hợp nóng chảy bắt đầu di chuyển về các cực tương ứng. Ion nhôm di chuyển về phía catôt, nơi chúng nhận electron và trở thành nhôm kim loại rắn. Đồng thời, ion oxi di chuyển về phía anôt, nơi chúng mất electron và tạo thành khí oxi. Nhôm kim loại sau đó được thu hồi từ đáy lò, trong khi khí oxi thoát ra ở phía trên.
Quá trình này không chỉ cung cấp một phương pháp sản xuất nhôm có hiệu quả cao mà còn giúp giảm lượng khí thải carbon dioxide so với các phương pháp sản xuất nhôm truyền thống.
Đây là một ví dụ của phản ứng oxi hóa-khử, trong đó Al2O3 đóng vai trò là chất khử và O2 là sản phẩm của quá trình oxi hóa.
* Phương trình điện phân nóng chảy:
2Al2O3 → 4Al + 3O2 ↑
2. Tìm hiểu Phản ứng hóa học điện phân nóng chảy: Al2O3 → Al + O2:
2.1. Điều kiện xảy ra phản ứng hóa học điện phân nóng chảy: Al2O3 → Al + O2:
Điều kiện xảy ra phản ứng hóa học điện phân nóng chảy Al2O3 để sản xuất kim loại nhôm và khí oxi bao gồm:
– Nhiệt độ cao và sự hiện diện của một chất điện ly như cryolite để giảm nhiệt độ nóng chảy của Al2O3, từ khoảng 2000°C xuống còn khoảng 950°C.
Quá trình này cũng cần một dòng điện mạnh để tách các ion Al3+ và O2- trong Al2O3.
Khi dòng điện chạy qua, ion nhôm di chuyển về phía cathode và ion oxy di chuyển về phía anode, nơi chúng tương ứng nhận và mất electron để trở thành nguyên tử tự do và tạo thành các nguyên tố tương ứng.
2.2. Hiện tượng của phản ứng hóa học điện phân nóng chảy: Al2O3 → Al + O2:
Dấu hiệu nhận biết phản ứng hóa học này xảy ra bao gồm sự giải phóng khí oxy tại anode và sự hình thành kim loại nhôm tại cathode. Trong trường hợp của phản ứng Al2O3 → Al + O2, chúng ta có thể quan sát thấy sự giải phóng khí oxy từ phản ứng. Điều này có thể được chứng minh thông qua việc thu thập và kiểm tra khí được giải phóng. Ngoài ra, sự giảm khối lượng của Al2O3 cũng là một dấu hiệu cho thấy đã xảy ra phản ứng hóa học, vì Al2O3 bị phân hủy thành nhôm và khí oxy.
2.3. Các bước thực hiện phản ứng hóa học điện phân nóng chảy: Al2O3 → Al + O2:
Các bước thực hiện phản ứng này bao gồm:
– Chuẩn bị một lượng Al2O3 cần thiết và đặt vào một lò nhiệt có khả năng đạt được nhiệt độ cao cần thiết cho phản ứng.
– Nung nóng Al2O3 ở nhiệt độ khoảng 2000°C để kích hoạt quá trình phân hủy.
– Duy trì nhiệt độ và áp suất thích hợp trong suốt quá trình phản ứng để đảm bảo rằng phản ứng diễn ra hoàn toàn và hiệu quả.
– Sau khi phản ứng hoàn tất, làm nguội hỗn hợp sản phẩm một cách cẩn thận để thu hồi nhôm kim loại và khí oxy.
* Lưu ý:
Khi thực hiện phản ứng hóa học Al2O3 → Al + O2, cần lưu ý một số điểm quan trọng sau đây:
– Nhiệt độ: Phản ứng này yêu cầu nhiệt độ rất cao để có thể xảy ra, thường là trên 2000°C. Do đó, việc cung cấp và duy trì nhiệt độ phù hợp là cần thiết.
– Cân bằng phản ứng: Đây là một phản ứng thuận nghịch, nên việc kiểm soát các điều kiện như nhiệt độ và áp suất để đạt được hiệu suất cao là quan trọng.
– An toàn: Do yêu cầu nhiệt độ cao, việc đảm bảo an toàn trong quá trình thực hiện phản ứng là vô cùng quan trọng để tránh các rủi ro như cháy nổ.
– Thiết bị: Cần sử dụng các loại lò phản ứng chịu được nhiệt độ cao và có khả năng cách nhiệt tốt.
– Môi trường phản ứng: Phải chú ý đến môi trường xung quanh, tránh sự hiện diện của các chất có thể phản ứng với Al hoặc O2 tạo thành sản phẩm không mong muốn.
– Tính kinh tế: Việc thực hiện phản ứng này có thể tốn kém do yêu cầu về năng lượng và thiết bị, do đó cần xem xét tính kinh tế khi quyết định thực hiện.
* Để thực hiện phản ứng hóa học Al2O3 → Al + O2 một cách an toàn, bạn cần tuân thủ các biện pháp:
– Sử dụng trang bị bảo hộ: Khi tiến hành phản ứng, hãy đảm bảo rằng bạn đã mặc đồ bảo hộ phù hợp như quần áo chống cháy, găng tay và kính bảo hộ.
– Kiểm soát nhiệt độ: Phản ứng cần nhiệt độ cao để xảy ra, vì vậy việc sử dụng các thiết bị có khả năng kiểm soát nhiệt độ chính xác là cần thiết.
– Giám sát liên tục: Phản ứng nên được giám sát liên tục để phát hiện sớm bất kỳ dấu hiệu bất thường nào có thể dẫn đến nguy hiểm.
– Có kế hoạch khẩn cấp: Chuẩn bị sẵn sàng các biện pháp ứng phó khẩn cấp như bình chữa cháy và đường thoát hiểm trong trường hợp có sự cố.
– Thực hiện trong môi trường kiểm soát: Cố gắng thực hiện phản ứng trong một môi trường được kiểm soát và cách ly, tránh xa các vật liệu dễ cháy và nổ.
– Đào tạo và giáo dục: Trước khi thực hiện phản ứng, hãy đảm bảo rằng tất cả những người liên quan đã được đào tạo về an toàn và biết cách xử lý các tình huống khẩn cấp.
2.4. Ứng dụng của phản ứng hóa học Al2O3 → Al + O2:
Ứng dụng của phản ứng hóa học Al2O3 → Al + O2 trong đời sống rất đa dạng và thiết thực. Phản ứng này là cơ sở của quá trình luyện kim, nơi mà nhôm được sản xuất từ quặng bauxite chứa alumina (Al2O3).
– Nhôm thu được sau phản ứng có thể được sử dụng trong nhiều lĩnh vực như sản xuất vật liệu xây dựng, chế tạo phương tiện giao thông, sản xuất dụng cụ gia đình và thiết bị điện tử.
– Ngoài ra, oxy sinh ra từ phản ứng cũng có nhiều ứng dụng quan trọng, bao gồm việc sử dụng trong y tế để hỗ trợ hô hấp, trong công nghiệp để cắt kim loại và làm giàu không khí trong các môi trường kín như tàu ngầm hoặc tàu vũ trụ.
3. Bài tập vận dụng liên quan:
Câu 1: Để điều chế Al kim loại, ta có thể dùng phương pháp nào sau đây?
A. Dùng Zn đẩy AlCl3 ra khỏi muối
B. Dùng CO khử Al2O3
C. Điện phân nóng chảy Al2O3
D. Điện phân dung dịch AlCl3
Đáp án: C. Điện phân nóng chảy Al2O3
Giải thích:
Kim loại nhôm được điều chế bằng phương pháp điện phân nóng chảy oxit nhôm
2Al2O3 dpnc > 4Al + 3O2
Câu 2: Cho hỗn hợp X gồm Al và Al2O3 có tỉ lệ khối lượng tương ứng là 0,18 : 1,02. Cho X tan trong dung dịch NaOH vừa đủ thu được dung dịch Y và 0,672 lít khí H2 (đktc). Cho Y tác dụng với 200 ml dung dịch HCl được kết tủa Z. Nung Z ở nhiệt độ cao đến khối lượng không đổi được 3,57g chất rắn. Nồng độ mol của dung dịch HCl là
A. 0,35M hoặc 0,45M.
B. 0,07M hoặc 0,11M.
C. 0,07M hoặc 0,09M.
D. 0,35M hoặc 0,55M.
Đáp án: D. 0,35M hoặc 0,55M.
Giải thích:
nH2 = 0,03
Bảo toàn electron: 3.nAl = 2.nH2
→ nAl = 0,02 → mAl = 0,54g
Al và Al2O3 có tỉ lệ khối lượng tương ứng là 0,18 : 1,02
→ mAl2O3 = 0,54/0,18.1,02 = 3,06 g
→ nAl2O3 bđ = 0,03 mol
Bảo toàn nguyên tố Al → nNaAlO2 = nAl + 2. nAl2O3 bđ = 0,08 mol
nAl2O3 thu được = 3,57 : 102 = 0,035 mol
nAl(OH)3= 0,07 mol
* Trường hợp 1: NaAlO2 + HCl + H2O → Al(OH)3 + NaCl
nHCl = nAl(OH)3 = 0,07 mol
→ CM HCl = 0,07/0,2 = 0,35M
* Trường hợp 2:
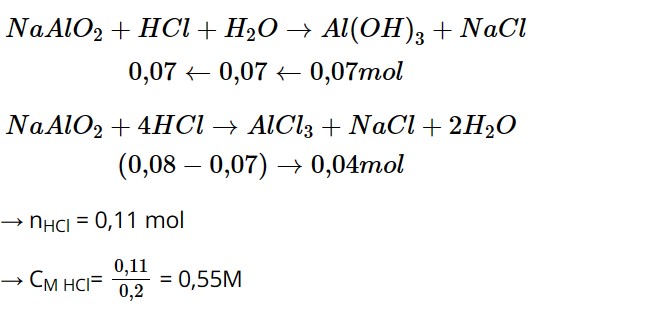
Câu 3: Để khử hoàn toàn mgam hỗn hợp CuO và PbO cần 8,1g kim loại nhôm, sau phản ứng thu được 50,2g hỗn hợp 2 kim loại. Giá trị của m là
A. 53,4g
B. 57,4g
C. 54,4g
D. 56,4g
Đáp án: B. 57,4g
Giải thích:
nAl = 8,1 : 27 = 0,3 mol
nAl2O3 = nAl/2 = 0,3/2 = 0,15 mol
Áp dụng định luật bảo toàn khối lượng:
mhhoxit + mAl = mAl2O3 +mKL
→ m + 8,1 = 0,15.102 + 50,2
→ m = 57,4 gam




