Phản ứng Zn + H2SO4 loãng tạo ra H2 bay lên thuộc loại phản ứng oxi hóa khử, phản ứng thế. Dưới đây là lý thuyết và một số bài tập có liên quan về Phản ứng hoá học: Zn + H2SO4 loãng → ZnSO4 + H2 cùng lời giải chi tiết. Xin mời các em học sinh cùng đón xem.
Mục lục bài viết
1. Phản ứng hóa học: Zn + H2SO4 loãng → ZnSO4 + H2:
Phản ứng hoá học giữa kẽm (Zn) và axit sulfuric loãng (H2SO4) tạo ra kẽm sulfat (ZnSO4) và khí hydro (H2). Trong phản ứng này, kẽm đóng vai trò là chất khử, mất đi electron để tạo ra ion Zn2+. Axit sulfuric loãng, với nồng độ không quá cao, nhận electron và được khử thành ion hydro sulfat (HSO4-) và sau đó là khí hydro. Phản ứng này được sử dụng trong nhiều ứng dụng thực tế như pin galvanic, xử lý kim loại, và cả trong giáo dục để minh họa cho các phản ứng oxi hóa – khử.
Trong phản ứng hoá học giữa kẽm (Zn) và axit sulfuric loãng (H2SO4), kẽm sẽ phản ứng với axit sulfuric để tạo thành kẽm sulfat (ZnSO4) và giải phóng khí hydro (H2). Cụ thể, kẽm sẽ nhường 2 electron (e-) cho hai ion hydro sulfat (HSO4-) có trong dung dịch axit sulfuric loãng, biến chúng thành khí hydro (H2) và nước (H2O), đồng thời tạo ra ion Zn2+. Phản ứng này minh họa cho quá trình oxi hóa – khử, nơi kẽm bị oxi hóa và ion hydro sulfat được khử. Đây là một phản ứng exothermic, tức là nó tỏa nhiệt khi diễn ra.
Phản ứng này được mô tả bằng phương trình cân bằng hóa học:
Zn + H2SO4 loãng → ZnSO4 + H2↑.
Mũi tên chỉ lên biểu thị rằng khí hydro được giải phóng ra khỏi dung dịch và đi lên trên.
2. Tìm hiểu về phản ứng hóa học: Zn + H2SO4 loãng → ZnSO4 + H2:
2.1. Điều kiện xảy ra phản ứng:
Điều kiện để phản ứng xảy ra bao gồm:
– Việc có mặt của axit sulfuric loãng và kẽm.
– Phản ứng diễn ra ngay trong điều kiện thường
2.2. Dấu hiệu nhận:
Các dấu hiệu nhận biết xảy ra phản ứng hóa học giữa kẽm (Zn) và axit sulfuric loãng (H2SO4) để tạo ra kẽm sulfat (ZnSO4) và khí hydro (H2) bao gồm sự thay đổi màu sắc, sự xuất hiện của bọt khí, và sự thay đổi nhiệt độ.
– Khi Zn được thêm vào H2SO4 loãng, chúng ta có thể quan sát thấy bọt khí hydro được giải phóng ra từ dung dịch, đây là một dấu hiệu rõ ràng cho thấy phản ứng hóa học đã xảy ra.
– Ngoài ra, nếu có sự tăng nhiệt độ của dung dịch, điều này cũng chỉ ra rằng phản ứng tỏa nhiệt.
– Sản phẩm của phản ứng, kẽm sulfat, là một chất rắn trắng, tan trong nước và thường được sử dụng trong ngành công nghiệp và phòng thí nghiệm.
2.3. Cách thực hiện:
* Các bước thực hiện:
Để thực hiện phản ứng này, bạn cần đảm bảo rằng axit sulfuric được sử dụng là loãng và không quá mạnh để tránh gây hại cho người thực hiện. Bạn cũng cần phải sử dụng các biện pháp an toàn như đeo kính bảo hộ, găng tay, và làm việc trong một không gian thông thoáng để tránh hít phải khí hidro được giải phóng.
Quy trình cụ thể như sau:
– Đổ một lượng nhỏ axit sulfuric loãng vào một bình chứa sạch.
– Thêm từ từ miếng kẽm vào bình chứa axit.
– Quan sát sự xuất hiện của bọt khí, đây là dấu hiệu cho thấy phản ứng đã bắt đầu.
– Khi phản ứng kết thúc, bạn sẽ thấy rằng miếng kẽm đã tan chảy hoàn toàn và dung dịch trong bình chứa trở nên trong suốt.
Lưu ý rằng khí hidro được giải phóng có thể cháy nếu tiếp xúc với ngọn lửa hoặc tia lửa điện, vì vậy cần phải hết sức cẩn thận khi xử lý.
* Những lưu ý về an toàn khi thực hiện:
Khi thực hiện phản ứng hóa học giữa kẽm (Zn) và axit sulfuric loãng (H2SO4), để tạo ra kẽm sulfat (ZnSO4) và khí hydro (H2), cần lưu ý một số điểm quan trọng sau đây.
– Đầu tiên, cần đảm bảo rằng axit sulfuric được sử dụng là loãng, vì axit sulfuric đặc có thể gây ra phản ứng mạnh và nguy hiểm.
– Thứ hai, phản ứng này nên được thực hiện trong một không gian thoáng đãng hoặc trong tủ hút khí để tránh việc hít phải khí hydro. Đối với khí hidro (H2) được giải phóng, vì nó là một khí dễ cháy và có thể gây nguy hiểm nếu tích tụ trong không gian kín, bạn cần đảm bảo rằng phòng thí nghiệm hoặc không gian làm việc của bạn được thông gió tốt. Khí hidro nên được thải ra ngoài môi trường một cách an toàn thông qua hệ thống thông gió hoặc bằng cách sử dụng một bình chứa khí chuyên dụng.
– Thứ ba, cần sử dụng đồ bảo hộ như kính bảo hộ, găng tay và áo choàng để tránh tiếp xúc trực tiếp với các hóa chất.
– Cuối cùng, sau khi phản ứng kết thúc, cần xử lý chất thải một cách cẩn thận theo quy định về an toàn và bảo vệ môi trường.
* Xử lí chất thải sau phản ứng hóa học:
Sau phản ứng hóa học giữa kẽm và axit sulfuric loãng, bạn cần thực hiện các bước cụ thể sau để xử lý chất thải an toàn:
– Đổ chất thải vào bình chứa có nhãn cảnh báo rõ ràng.
– Kiểm tra với quy định địa phương về việc xử lý chất thải hóa học.
– Phân loại chất thải theo hướng dẫn của cơ quan quản lý chất thải.
– Gửi chất thải đến điểm thu gom hoặc xử lý chất thải hóa học được chỉ định.
– Lưu giữ hồ sơ về việc xử lý và vận chuyển chất thải để theo dõi và kiểm tra sau này.
Nhớ rằng việc tuân thủ nghiêm ngặt các quy trình an toàn không chỉ bảo vệ bạn mà còn góp phần bảo vệ môi trường sống xung quanh.
2.4. Cân bằng phương trình hóa học:
* Cân bằng bằng phương pháp kiểm tra:
Đầu tiên, ta đặt tất cả các hệ số bằng 1:
1 Zn + 1 H2SO4 (loãng) = 1 ZnSO4 + 1 H2
Đối với mỗi nguyên tố, ta kiểm tra xem số lượng nguyên tử có cân bằng ở cả hai phía của phương trình hay không.
– Zn được cân bằng: 1 nguyên tử bên chất phản ứng và 1 nguyên tử bên chất sản phẩm.
– H được cân bằng: 2 nguyên tử bên chất phản ứng và 2 nguyên tử bên chất sản phẩm.
– S được cân bằng: 1 nguyên tử bên chất phản ứng và 1 nguyên tử bên chất sản phẩm.
– O được cân bằng: 4 nguyên tử bên chất phản ứng và 4 nguyên tử bên chất sản phẩm.
Tất cả các nguyên tử bây giờ được cân bằng và toàn bộ phương trình được cân bằng hoàn toàn, ta có:
Zn + H2SO4(loãng) = ZnSO4 + H2
* Cân bằng bằng phương pháp đại số:
Đầu tiên, chúng ta thiết lập tất cả các hệ số thành các biến a, b, c, d,…
a Zn + b H2SO4(loãng) = c ZnSO4 + d H2
Bây giờ, viết ra các phương trình đại số để cân bằng từng nguyên tử:
Zn: a * 1 = c * 1
H: b * 2 = d * 2
S: b * 1 = c * 1
O: b * 4 = c * 4
Sau đó chúng ta gán a = 1 và giải hệ phương trình đại số tuyến tính:
a = c
b * 2 = d * 2
b = c
b * 4 = c * 4
a = 1
Giải hệ thống đại số tuyến tính này, ta được:
a = 1
b = 1
c = 1
d = 1
Để có được hệ số nguyên, chúng ta nhân tất cả các biến với 1:
a = 1
b = 1
c = 1
d = 1
Bây giờ chúng ta thay thế các biến trong các phương trình ban đầu bằng các giá trị thu được bằng cách giải hệ thống đại số tuyến tính và được phương trình cân bằng hoàn toàn:
Zn + H2SO4(loãng) = ZnSO4 + H2
3. Bài tập vận dụng liên quan:
Câu 1: Cho 0,52 gam hỗn hợp 2 kim loại Mg, Al tan hoàn toàn trong dung dịch H2SO4 loãng dư thu được 0,336 lít khí ở đktc. Khối lượng muối sunfat thu được là:
A. 1,24gam
B. 6,28gam
C. 1,96gam
D. 3,4gam.
Đáp án: C
Hướng dẫn giải:
Áp dụng nhanh công thức:
mmuối = mKL + ![]() = 0,52 + 0,015. 96 = 1,96 gam.
= 0,52 + 0,015. 96 = 1,96 gam.
Câu 2: Cho 21 gam hỗn hợp Zn và CuO phản ứng vừa đủ với 600 ml dung dịch H2SO4 0,5M. Phần trăm khối lượng của Zn có trong hỗn hợp ban đầu là
A. 57%
B. 62%
C. 69%
D. 73%
Đáp án: B
Hướng dẫn giải:
Đặt 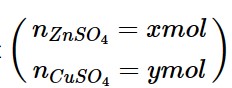
→ 65x + 80y = 21 (1)
![]()
→ x + y = 0,3 mol (2)
→ x = 0,2 mol; y = 0,1 mol
→ %mZn= 62%
Câu 3: Cho 2,81 gam hỗn hợp gồm 3 oxit Fe2O3, MgO, ZnO tan vừa đủ trong 300ml dung dịch H2SO4 0,1M thì khối lượng muối sunfat khan tạo thành là:
A. 5,33gam
B. 5,21gam
C. 3,52gam
D. 5,68gam.
Đáp án: B
Hướng dẫn giải:
nO (oxit) = nH+/2 = 0,03 mol
→ mKL = m oxit – mO(oxit) = 2,81 – 0,03.16 = 2,33 gam
mmuối = mKL + ![]() = 2,33 + 0,03.96 = 5,21gam
= 2,33 + 0,03.96 = 5,21gam
THAM KHẢO THÊM:














