Mục lục bài viết
- 1 1. Phản ứng hóa học: Cr + HCl → CrCl2 + H2 ↑ | Cr ra CrCl2:
- 2 2. Tìm hiểu phản ứng hóa học: Cr + HCl → CrCl2 + H2 ↑ | Cr ra CrCl2:
- 2.1 2.1. Điều kiện xảy ra phản ứng hóa học Cr + HCl → CrCl2 + H2 ↑ | Cr ra CrCl2:
- 2.2 2.2. Dấu hiệu nhận biết xảy ra phản ứng hóa học Cr + HCl → CrCl2 + H2 ↑ | Cr ra CrCl2:
- 2.3 2.3. Thực hiện phản ứng hóa học Cr + HCl → CrCl2 + H2 ↑ | Cr ra CrCl2:
- 2.4 2.4. Cân bằng phương trình hóa học Cr + HCl → CrCl2 + H2 ↑ | Cr ra CrCl2:
- 2.5 2.5. Ứng dụng của phản ứng hóa học Cr + HCl → CrCl2 + H2 ↑ | Cr ra CrCl2:
- 3 3. Bài tập vận dụng liên quan:
1. Phản ứng hóa học: Cr + HCl → CrCl2 + H2 ↑ | Cr ra CrCl2:
Phản ứng hóa học giữa crom và axit clohidric tạo ra crom clorua và khí hidro. Trong phản ứng này, crom (Cr) phản ứng với axit clohidric (HCl) để tạo thành crom clorua (CrCl2) và khí hidro (H2 ↑).
Phản ứng này là một ví dụ của phản ứng oxi hóa-khử, nơi crom bị oxi hóa từ trạng thái hóa trị không sang trạng thái hóa trị +2, và hidro bị khử từ trạng thái hóa trị +1 trong HCl sang trạng thái hóa trị 0 khi nó được giải phóng dưới dạng khí hidro.
Crom clorua (CrCl2) có thể ảnh hưởng đến sức khỏe con người theo nhiều cách khác nhau. Khi tiếp xúc ở mức độ cao, CrCl2 có thể gây ra các vấn đề sức khỏe như kích ứng da, mắt và đường hô hấp. Trong một số trường hợp, tiếp xúc lâu dài có thể dẫn đến các vấn đề nghiêm trọng hơn như bệnh phổi hoặc ung thư. Tuy nhiên, crom clorua cũng được nghiên cứu với tư cách là một chất bổ sung vi lượng có thể có lợi cho sức khỏe, như cải thiện kiểm soát đường huyết ở người bị tiểu đường. Quan trọng là phải hiểu rằng tác động của CrCl2 đối với sức khỏe phụ thuộc vào liều lượng và phương thức tiếp xúc. Cần tuân thủ các biện pháp an toàn khi làm việc với hóa chất này để giảm thiểu rủi ro.
2. Tìm hiểu phản ứng hóa học: Cr + HCl → CrCl2 + H2 ↑ | Cr ra CrCl2:
2.1. Điều kiện xảy ra phản ứng hóa học Cr + HCl → CrCl2 + H2 ↑ | Cr ra CrCl2:
Điều kiện cần thiết để phản ứng xảy ra là có mặt của cả hai chất phản ứng và một lượng nhiệt đủ để kích hoạt phản ứng.
2.2. Dấu hiệu nhận biết xảy ra phản ứng hóa học Cr + HCl → CrCl2 + H2 ↑ | Cr ra CrCl2:
Dấu hiệu nhận biết một phản ứng hóa học có thể bao gồm sự thay đổi màu sắc, sự tạo thành kết tủa, sự phát triển khí, hoặc sự thay đổi nhiệt độ.
Trong phản ứng giữa Cr và HCl, chúng ta có thể quan sát thấy sự phát triển khí hydro (H2 ↑) là một dấu hiệu rõ ràng của phản ứng hóa học xảy ra.
Ngoài ra, sự hình thành của CrCl2 cũng là một chỉ báo cho thấy đã có sự chuyển hóa hóa học. Sự giải phóng khí hydro có thể được nhận biết qua việc thu thập và kiểm tra khí thoát ra, ví dụ như bằng cách đốt cháy nó và quan sát ngọn lửa màu xanh lam đặc trưng của khí hydro khi cháy trong không khí.
2.3. Thực hiện phản ứng hóa học Cr + HCl → CrCl2 + H2 ↑ | Cr ra CrCl2:
Các bước thực hiện phản ứng hóa học giữa crom và axit clohidric để tạo ra crom clorua và khí hidro được mô tả chi tiết như sau:
– Chuẩn bị dung dịch HCl loãng bằng cách pha loãng axit clohidric với nước theo tỷ lệ phù hợp trong bình phản ứng.
– Thêm từ từ lượng crom dạng bột hoặc mảnh vào bình chứa dung dịch HCl, đảm bảo rằng crom được phân tán đều trong dung dịch.
– Khi crom tiếp xúc với HCl, phản ứng sẽ bắt đầu và khí hidro sẽ được giải phóng dưới dạng bọt khí mịn, quan sát sự thay đổi màu sắc của dung dịch.
– Khuấy nhẹ dung dịch để tăng tốc độ phản ứng và đảm bảo phản ứng xảy ra hoàn toàn.
– Tiếp tục quan sát cho đến khi không còn thấy bọt khí mới được tạo ra, điều này cho thấy phản ứng đã hoàn toàn.
– Sau khi phản ứng kết thúc, thu được dung dịch chứa crom clorua CrCl2, có thể được tách ra từ dung dịch thông qua quá trình lọc hoặc bay hơi.
* Lưu ý:
Quá trình này cần được thực hiện trong phòng thí nghiệm có trang bị hệ thống thông gió tốt để đảm bảo an toàn và tránh hít phải khí hidro thoát ra. Ngoài ra, việc thực hiện phản ứng nên được giám sát cẩn thận bởi người có kinh nghiệm để đảm bảo an toàn và hiệu quả.
* Đối với việc xử lý chất thải:
– Chất thải rắn như crom dư và các chất không tan cần được thu gom và xử lý theo quy định về chất thải nguy hại.
– Dung dịch sau phản ứng chứa CrCl2 cần được trung hòa trước khi xả vào hệ thống thoát nước để đảm bảo không gây ô nhiễm môi trường.
– Khí hidro thoát ra cần được xử lý an toàn để tránh nguy cơ cháy nổ.
2.4. Cân bằng phương trình hóa học Cr + HCl → CrCl2 + H2 ↑ | Cr ra CrCl2:
Cr + 2HCl → CrCl2 + H2
Cách cân bằng phương trình hoá học theo phương pháp thăng bằng electron:
– Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hoá, từ đó xác định chất oxi hoá – chất khử:
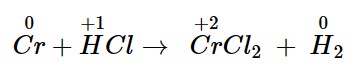
Chất khử: Cr; chất oxi hoá: HCl.
– Bước 2: Biểu diễn quá trình oxi hoá, quá trình khử
+ Quá trình oxi hoá: ![]()
+ Quá trình khử: ![]()
– Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hoá
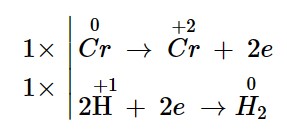
– Bước 4: Điền hệ số của các chất có mặt trong phương trình hoá học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
Cr + 2HCl → CrCl2 + H2
2.5. Ứng dụng của phản ứng hóa học Cr + HCl → CrCl2 + H2 ↑ | Cr ra CrCl2:
– Crom clorua (CrCl2) được sử dụng trong nhiều ứng dụng khác nhau. Nó thường được sử dụng trong quá trình mạ crom, nơi nó giúp tạo ra một lớp phủ bảo vệ chống lại sự ăn mòn.
– CrCl2 cũng được sử dụng trong ngành công nghiệp dệt để giúp nhuộm vải, cung cấp màu sắc đậm và bền vững.
– Trong phòng thí nghiệm, crom clorua có thể được sử dụng như một chất xúc tác trong các phản ứng hóa học, hoặc như một chất chuẩn đoán để xác định sự hiện diện của các ion khác trong dung dịch.
– Ngoài ra, CrCl2 còn có vai trò quan trọng trong sản xuất các loại thuốc và trong y học, nơi nó được nghiên cứu với tư cách là một chất bổ sung vi lượng có thể có lợi cho sức khỏe con người.
– Khí hydro (H2) được sinh ra từ phản ứng này cũng có nhiều ứng dụng quan trọng, chẳng hạn như làm nhiên liệu cho các tế bào nhiên liệu hydro và trong các quá trình sản xuất hóa chất khác.
3. Bài tập vận dụng liên quan:
Câu 1: Chọn phát biểu đúng về phản ứng của crom với phi kim:
A. Ở nhiệt độ cao, clo sẽ oxi hóa crôm thành Cr(VI)
B. Lưu huỳnh không phản ứng được với Crom
C. Ở nhiệt độ cao, clo sẽ oxi hóa crôm thành Cr(II)
D. Ở nhiệt độ thường, crom chỉ phản ứng với flo
Đáp án:
D. Ở nhiệt độ thường, crom chỉ phản ứng với flo
Giải thích:
– D. Đúng: Flo là phi kim có tính oxi hóa rất mạnh nên có thể phản ứng với crom ngay ở nhiệt độ thường.
– A và C Sai vì ở nhiệt độ cao oxi và clo đều oxi hóa crom thành Cr(III).
– B. Sai: Crom tác dụng được với lưu huỳnh ở nhiệt độ cao.
Câu 2: Sản phẩm của phản ứng nào sau đây không đúng?
A. 2Cr + KClO3 →Cr2O3 + KCl
B. 2Cr + 3KNO3 →Cr2O3 + 3KNO2
C. 2Cr + 3H2SO4 →Cr2(SO4)3 + 3H2
D. 2Cr + N2 →2CrN
Đáp án C. 2Cr + 3H2SO4 →Cr2(SO4)3 + 3H2
Giải thích:
Crom phản ứng với axit HCl hoặc H2SO4 loãng sinh ra khí H2 và muối Cr2+
Cr + H2SO4 → CrSO4 + H2
Câu 3: Tiến hành phản ứng nhiệt nhôm với một hỗn hợp gồm 8,1 gam Al và 15,2 gam Cr2O3, sau phản ứng thu được hỗn hợp X. Cho hỗn hợp X vào dung dịch NaOH dư, đun nóng thấy thoát ra 5,04 lít H2 (đktc). Khối lượng crom thu được là
A. 5,2 gam
B. 10,4 gam
C. 8,32 gam
D. 7,8 gam.
Đáp án: D. 7,8 gam
Giải thích:
nH2 = 5,04 : 22,4 = 0,025 mol
nAl ban đầu = 0,3 mol;
nCr2O3 ban đầu = 0,1 mol
Hỗn hợp X phản ứng với NaOH tạo khí H2 → Al dư
Bảo toàn electron: 3.nAl = 2.nH2
→ nAl dư = 0,15 mol
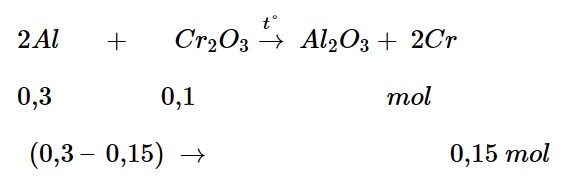
→ mCr = 0,15.52 = 7,8 gam.
Câu 4: Số oxi hóa của Crom trong các hợp chất là:
A. 0, +2, +3.
B. 0, +2, +3, +6.
C. +1, +2, +3, +4, +5, +6.
D. +2, +3, +6.
Đáp án: D. +2, +3, +6
Giải thích:
Số oxi hóa của Crom trong các hợp chất là: +2, +3, +6
0 là số oxi hóa của crom đơn chất.
Câu 5: Crom không tác dụng với nước vì:
A. Có lớp hiđroxit bảo vệ
B. Khí H2 ngăn cản phản ứng
C. Có thể điện cực chuẩn lớn
D. Có lớp oxi bảo vệ
Đáp án: A. Có lớp hiđroxit bảo vệ
Giải thích: Crom bền với nước và không khí do có màng oxit rất mỏng, bền bảo vệ.




