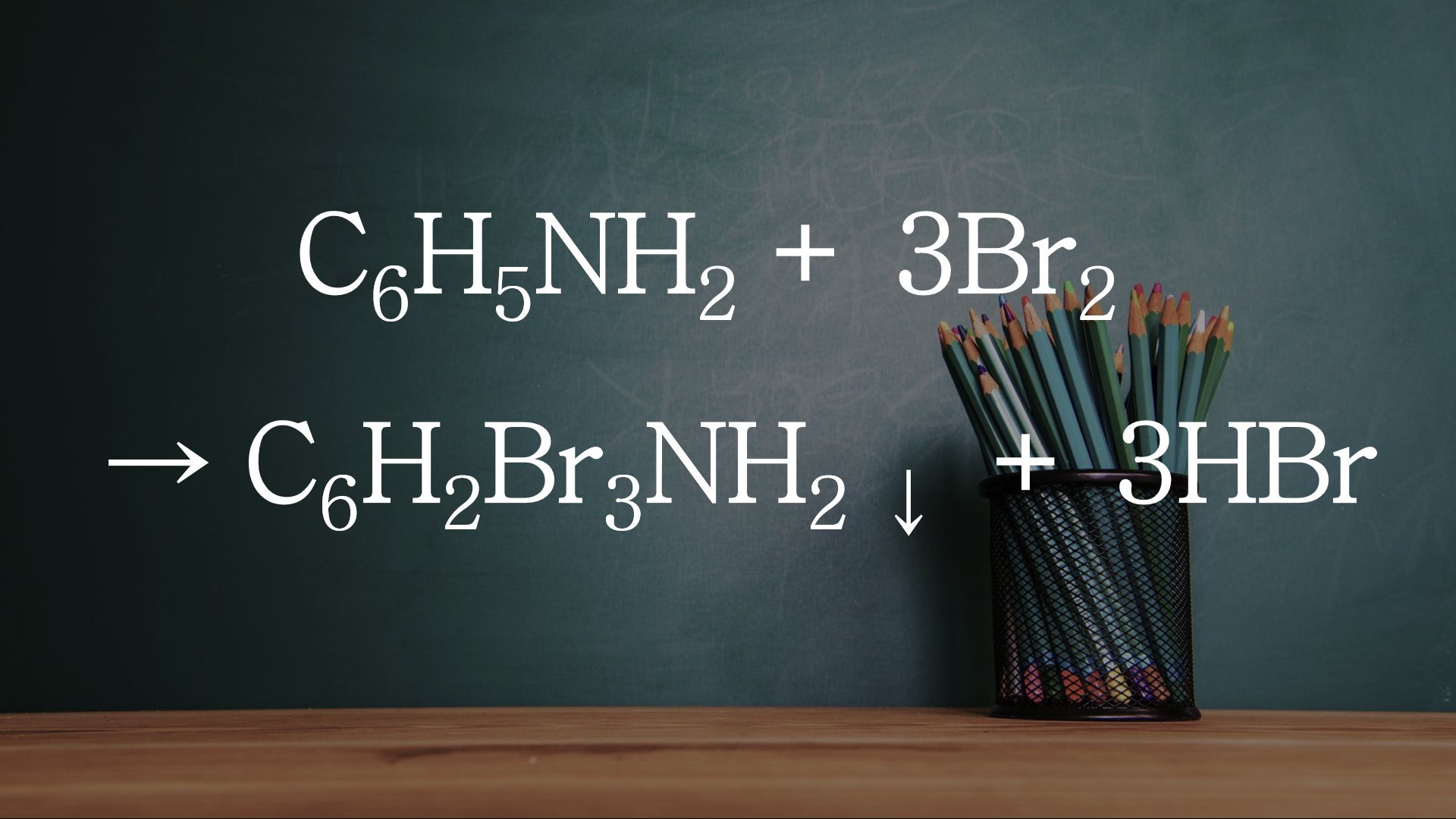Dưới đây là lý thuyết về phản ứng C6H5NH2 + Br2 hay Anilin + Br2 thuộc loại phản ứng thế ở nhân thơm cùng phương trình hóa học đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về C6H5NH2 có lời giải, mời các bạn học sinh đón xem.
Mục lục bài viết
1. Phản ứng hoá học: C6H5NH2 + Br2 → C6H3Br3NH2 + HBr:
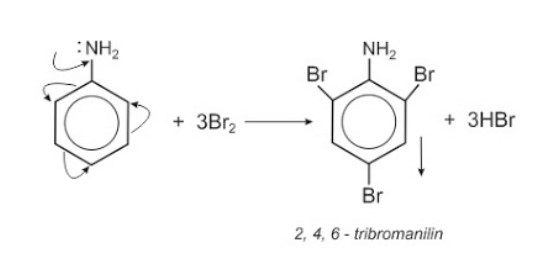
Phản ứng hoá học: C6H5NH2 + Br2 → C6H3Br3NH2 + HBr là một ví dụ của phản ứng brom hóa, nơi anilin (C6H5NH2) tác dụng với brom (Br2) để tạo ra 2,4,6-tribromanilin (C6H2Br3NH2) và axit bromhidric (HBr). Phản ứng này thường được thực hiện trong môi trường nước hoặc dung môi hữu cơ, và nhiệt độ cần được kiểm soát chặt chẽ để đảm bảo rằng phản ứng diễn ra đúng hướng và để tránh sự tạo thành các sản phẩm phụ không mong muốn.
Trong phản ứng này, ba nguyên tử hydro trong nhóm phenyl của anilin được thay thế bởi ba nguyên tử brom, điều này cho thấy tính chất electrophilic của brom khi nó tác dụng với hợp chất hữu cơ chứa nhóm amino.
Phản ứng brom hóa của anilin xảy ra do nhóm amino (-NH2) trên Anilin phản ứng với brom do hiệu ứng liên hợp của nhóm amino (-NH2) với vòng benzen. Nhóm amino là nhóm đẩy electron, nó đẩy electron vào vòng benzen, làm tăng mật độ electron tại các vị trí ortho và para so với nhóm amino. Điều này làm cho vòng benzen hoạt động hơn trong phản ứng thế với các tác nhân electrophilic như brom. Khi brom được thêm vào, nó sẽ phản ứng với các vị trí có mật độ electron cao này, dẫn đến việc thay thế các nguyên tử hydro bằng brom và tạo ra sản phẩm 2,4,6-tribromanilin. Đây là một phản ứng thế ở nhân thơm, nơi các nguyên tử hydro trong nhóm phenyl được thay thế bởi các nguyên tử brom. Nước brom là một chất oxi hóa mạnh, có khả năng phản ứng với anilin để tạo thành kết tủa trắng, điều này cũng giúp nhận biết sự hiện diện của anilin.
Phản ứng brom hóa là một phần của lớp phản ứng hóa học rộng lớn hơn được gọi là phản ứng thế, nơi một nguyên tử hoặc nhóm nguyên tử trong một phân tử được thay thế bởi một nguyên tử hoặc nhóm nguyên tử khác. Phản ứng này có nhiều ứng dụng trong hóa học tổng hợp, như việc tạo ra các hợp chất dẫn xuất mới có thể có hoạt tính sinh học hoặc các tính chất vật lý đặc biệt. Nó cũng là một công cụ quan trọng trong ngành công nghiệp dược phẩm, nơi nó có thể được sử dụng để điều chế các hợp chất dược liệu mới hoặc cải thiện tính chất của các hợp chất hiện có. Đối với những ai quan tâm đến hóa học hữu cơ và các phản ứng của nó, phản ứng brom hóa là một ví dụ điển hình về cách các phản ứng hóa học có thể được sử dụng để biến đổi các hợp chất hữu cơ và tạo ra các sản phẩm mới với các tính chất và ứng dụng khác nhau. Đây là một lĩnh vực nghiên cứu hấp dẫn và liên tục phát triển, với nhiều khám phá mới đang được thực hiện mỗi ngày.
2. Tìm hiểu thêm Phản ứng hoá học: C6H5NH2 + Br2 → C6H3Br3NH2 + HBr:
2.1. Điều kiện xảy ra phản ứng:
Điều kiện cần thiết cho phản ứng này là:
– Sự hiện diện của brom dưới dạng nước brom.
– Phản ứng thường được thực hiện ở nhiệt độ thường.
2.2. Dấu hiệu nhận biết xảy ra phản ứng:
Trong trường hợp này, có thể quan sát thấy sự thay đổi màu sắc do sự hình thành của sản phẩm tribromanilin, có màu sẫm hơn so với anilin ban đầu.
Ngoài ra, sự giải phóng khí HBr cũng là một dấu hiệu của phản ứng, cũng như sự tỏa nhiệt có thể xảy ra do bản chất tỏa nhiệt của phản ứng thế này.
Để xác định chính xác sự diễn ra của phản ứng, các phương pháp phân tích như chromatography hoặc quang phổ hấp thụ có thể được sử dụng để phân tích sản phẩm và xác nhận sự hình thành của tribromanilin và axit bromhidric.
Đây là một phần của quá trình nghiên cứu và phát triển trong hóa học hữu cơ, nơi các phản ứng như vậy có thể được sử dụng để tạo ra các hợp chất mới cho nghiên cứu hoặc ứng dụng công nghiệp.
2.3. Thực hiện phản ứng:
Để thực hiện phản ứng này, bạn cần chuẩn bị một dung dịch của C6H5NH2 và thêm từ từ Br2 vào trong điều kiện kiểm soát.
Khi Br2 được thêm vào, nó sẽ phản ứng với nhóm NH2 của C6H5NH2, tạo thành sản phẩm C6H3Br3NH2 và giải phóng HBr.
Quá trình này cần được thực hiện trong một bình phản ứng kín để tránh sự bay hơi của Br2 và cần có sự hiện diện của một chất xúc tác thích hợp nếu cần. Nhiệt độ phản ứng cũng cần được kiểm soát chặt chẽ, vì Br2 có thể phản ứng mạnh với nhiều hợp chất hữu cơ khác nếu nhiệt độ quá cao.
Sau khi phản ứng hoàn tất, sản phẩm có thể được tách ra từ hỗn hợp phản ứng bằng cách chưng cất hoặc lọc, và sau đó được rửa sạch để loại bỏ bất kỳ tạp chất nào còn sót lại.
Nơi kiểm soát chặt chẽ các điều kiện phản ứng là chìa khóa để đạt được kết quả mong muốn và tránh tạo ra sản phẩm phụ không mong muốn.
2.4. Cân bằng phương trình hóa học:
C6H5NH2 + 3Br2 → C6H2Br3NH2 + 3HBr.
* Cách cân bằng:
– Bước 1: Dán nhãn mỗi hợp chất bằng một biến
Dán nhãn mỗi hợp chất (chất phản ứng hoặc chất sản phẩm) trong phương trình bằng một biến để biểu diễn các hệ số chưa biết.
a C6H5NH2 + b Br2 = c C6H2Br3NH2 + d HBr
– Bước 2: Tạo một hệ phương trình
Tạo một phương trình cho mỗi nguyên tố (C, H, N, Br) trong đó mỗi số hạng đại diện cho số lượng nguyên tử của nguyên tố trong mỗi chất phản ứng hoặc sản phẩm.
C: 6a + 0b = 6c + 0d
H: 7a + 0b = 4c + 1d
N: 1a + 0b = 1c + 0d
Br: 0a + 2b = 3c + 1d
– Bước 3: Giải tất cả các biến
Sử dụng phương pháp thay thế hoặc loại bỏ:
6a – 6c = 0
7a – 4c – 1d = 0
1a – 1c = 0
2b – 3c – 1d = 0
Đơn giản hóa kết quả để có được các giá trị số nguyên thấp nhất:
a = 1 (C6H5NH2)
b = 3 (Br2)
c = 1 (C6H2Br3NH2)
d = 3 (HBr)
– Bước 4: Thay thế hệ số và xác minh kết quả
Đếm số nguyên tử của mỗi nguyên tố ở mỗi bên của phương trình và xác minh rằng tất cả các nguyên tố và electron (nếu có điện tích / ion) đều cân bằng.
C6H5NH2 + 3 Br2 = C6H2Br3NH2 + 3 HBr
2.5. Ứng dụng của phản ứng:
Sản phẩm của phản ứng này, 2,4,6-tribromanilin, là một chất trung gian quan trọng trong tổng hợp các hợp chất hữu cơ, đặc biệt là trong sản xuất thuốc nhuộm và chất tẩy rửa. Ngoài ra, nó còn được sử dụng trong việc sản xuất thuốc diệt cỏ và một số loại thuốc khác.
Điều thú vị là phản ứng này cũng có thể được sử dụng để nhận biết anilin, vì khi anilin tác dụng với brom, nó tạo ra kết tủa trắng, giúp dễ dàng phân biệt anilin với các hợp chất khác.
Tính chất vật lý của anilin, như là chất lỏng không màu, sôi ở 184°C và độc tính cao, cũng làm cho nó trở thành một hợp chất quan trọng trong nghiên cứu và ứng dụng hóa học. Anilin cũng có thể bị oxi hóa bởi oxi trong không khí, dẫn đến việc chuyển màu sang đen, điều này cần được lưu ý khi bảo quản.
Phản ứng của anilin với brom diễn ra ở nhiệt độ thường, làm cho nó trở thành một phản ứng hóa học tiện lợi để thực hiện trong phòng thí nghiệm hoặc trong sản xuất công nghiệp. Điều này cho thấy sự linh hoạt và tính ứng dụng cao của phản ứng trong nhiều lĩnh vực khác nhau của khoa học và công nghệ.
Điều chế và sử dụng anilin và các sản phẩm của nó đòi hỏi sự hiểu biết sâu sắc về hóa học và kỹ thuật, cũng như một sự cân nhắc cẩn thận về các yếu tố an toàn và môi trường. Các nhà hóa học và kỹ sư hóa học phải luôn luôn nắm vững kiến thức về tính chất và phản ứng của các hợp chất này để tối ưu hóa quy trình sản xuất và đảm bảo sự an toàn trong quá trình sử dụng.
3. Bài tập vận dụng liên quan kèm đáp án:
Câu 1: Dung dịch chất nào sau đây làm quỳ tím chuyển sang màu xanh?
A. Glyxin.
B. Metylamin.
C. Anilin.
D. Glucozơ.
Đáp án: B
Dung dịch metylamin (CH3NH2) làm quỳ tím chuyển sang màu xanh vì metyl amin khi tan trong nước phản ứng với nước sinh ra ion OH-
![]()
Câu 2: Amin no, đơn chức, mạch hở có công thức tổng quát là
A. CnH2nN.
B. CnH2n+1N.
C. CnH2n+3N.
D. CnH2n+2N.
Đáp án: C
Amin no, đơn chức, mạch hở có công thức tổng quát là CnH2n+3N.
Câu 3: Cho 10 gam hỗn hợp 2 amin no đơn chức, mạch hở tác dụng vừa đủ với V ml dung dịch HC1 1M, thu được dung dịch chứa 15,84 gam hỗn hợp muối. Giá trị của V là
A. 80
B. 320
C. 200
D. 160
Đáp án: D
Gọi công thức chung của hai amin đơn chức là RNH2.
RNH2 + HCl → RNH3Cl
Bảo toàn khối lượng ta có:
mHCl = 15,84 − 10 = 5,84 gam
⇒nHCl = 0,16 mol
⇒VHCl = 0,16/1 = 0,16 lít = 160 ml
THAM KHẢO THÊM: