Phản ứng Cl2 + H2O ⇄ HCl + HClO là phản ứng oxi hóa khử. Clo trong phản ứng này không chỉ hoạt động như một chất oxi hóa mà còn đồng thời là một chất khử. Bài viết sau sẽ cung cấp đầy đủ thông tin về chi tiết đặc điểm phương trình hóa học này và các dạng bài tập liên quan, mời các bạn cùng tham khảo.
Mục lục bài viết
1. Phương trình phản ứng Cl2+ H2O ⇄ HCl + HClO:
Clo trong phản ứng này không chỉ hoạt động như một chất oxi hóa mà còn đồng thời là một chất khử. Phản ứng diễn ra theo chiều ngược do axit hypochlorous (HClO) thể hiện khả năng oxi hóa mạnh, có thể chuyển HCl thành Cl2 và H2O. Bởi vì HClO là một chất oxi hóa mạnh, nước clo kết quả cũng có khả năng làm tẩy màu.
– Điều kiện phản ứng xảy ra: Nhiệt độ thường
– Hiện tượng nhận biết phản ứng: Khi hòa tan trong nước, clo phản ứng với nước để tạo thành một hỗn hợp gồm axit clohiđric và axit hypochlorous.
– Tiến hành phản ứng Clo tác dụng với nước
Thực hiện phản ứng giữa clo và nước, khi clo tan trong nước, một phần khí clo tương tác với nước và hình thành một hỗn hợp gồm axit clohiđric và axit hypochlorous. Trong quá trình phản ứng này, clo thể hiện tính chất đồng thời là chất oxi hóa và chất khử, khi một phần nguyên tử clo bị oxi hóa thành Cl+1 và một nguyên tử clo khác bị khử thành Cl-1. Phản ứng này có chiều ngược do axit hypochlorous (HClO) là chất oxi hóa mạnh, có khả năng oxi hóa HCl thành Cl2 và H2O. Đồng thời, tính chất mạnh mẽ của HClO cũng làm cho nước clo có khả năng tẩy màu.
2. Tính chất của Clo:
Tác dụng với kim loại:
Đa số kim loại và có to để khơi màu phản ứng tạo muối clorua (có hoá trị cao nhất )
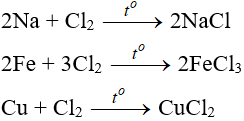
Tác dụng với phi kim:
(cần có nhiệt độ hoặc có ánh sáng)
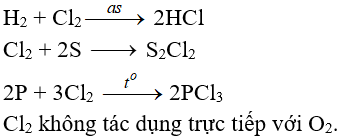
Tác dụng với nước và dung dịch kiềm:
Cl2 tham gia phản ứng với vai trò vừa là chất ôxi hóa, vừa là chất khử.
– Tác dụng với nuớc
Khi hoà tan vào nước, một phần Clo tác dụng (Thuận nghịch)
Cl20 + H2O → HCl + HClO (Axit hipoclorơ)
Axit hipoclorơ có tính oxy hoá mạnh, nó phá hửy các màu vì thế nước clo hay clo ẩm có tính tẩy màu do.
– Tác dụng với dung dịch bazơ
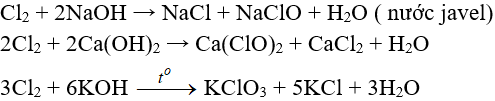
Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Cl2 + 2KI → 2KCl + I2
Tác dụng với chất khử khác
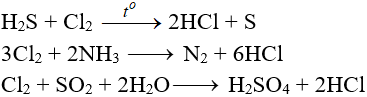
Phản ứng thế, phản ứng cộng, phản ứng phân huỷ với một số hợp chất hữu cơ
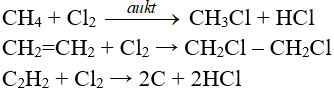
Ứng dụng
Ứng dụng chủ yếu nhất của clo là dùng để điều chế nhựa PVC cũng như các chất dẻo hay cao su. Ngoài ra, với tính oxi hóa và tính khử, CLORAMIN còn được dùng để khử trùng nước sinh hoạt. Clo còn là một trong những thành phần để điều chế nước javen tẩy trắng quần áo, vải sợi…
3. Tính chất của H2O:
3.1. Nước tác dụng với kim loại
Ở điều kiện thường, nước có thể phản ứng với các kim loại mạnh như Li, Ca, Na, K, Ba,… để tạo thành dung dịch Bazo và khí Hidro.
H2O + Kim loại → Bazơ + H2↑
2M + 2nH2O → 2M(OH)n + nH2↑
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Ba + 2H2O → Ba(OH)2 + H2
Đặc biệt, một số kim loại trung bình như Mg, Zn, Al, Fe,…phản ứng được với hơi nước ở nhiệt độ cao tạo ra oxit kim loại và hidro. Bên cạnh đó, kim loại Mg tan rất chậm trong nước nóng.
3.2. Nước tác dụng với oxit bazo
Nước tác dụng với một số oxit bazo như Na2O, CaO , K2O,… tạo thành dung dịch bazo tương ứng. Dung dịch bazo làm cho quỳ tím hóa xanh.
H2O + Oxit bazơ → Bazơ
Na2O + H2O → 2NaOH
Li2O + H2O→ 2LiOH
K2O + H2O→ 2KOH
CaO + H2O → Ca(OH)2
3.3. Nước tác dụng với oxit axit
Nước tác dụng với oxit axit tạo thành axit tương ứng. Dung dịch axit làm quỳ tím hóa đỏ.
H2O + Oxit axit → Axit
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
4. Tính chất của HClO:
HClO là một axit yếu có công thức hóa học là HClO (hoặc HOCl trong một số ngành công nghiệp). Đây là một chất khử trùng được sử dụng rộng rãi trong việc khử trùng và làm sạch các bể bơi. Axit hipoclorơ là một trong những chất khử trùng phổ biến và hiệu quả được ưa chuộng trong nhiều ứng dụng hiện đại.
Tính chất vật lý
Một phân tử axit hipoclorơ HClO có trọng lượng là 52,46 g/mol và độ pH là 7,53. Ở điều kiện thường, HClO tồn tại dưới dạng dung dịch lỏng không màu và có khả năng hòa tan trong nước. Axit clo không ổn định và chuyển hóa thành axit hypochlorous ở trạng thái oxy hóa +1, thể hiện tính chất đặc trưng là tác nhân oxy hóa mạnh, có thể gây nổ hóa học khi tiếp xúc với các chất khác.
Tính chất hóa học
– Phản ứng phân ly: Dạng anion hypochlorite, ở cả trạng thái dung dịch và trạng thái ngậm nước, tham gia phản ứng thuận nghịch: HClO ⇔ OCl- + H+
– Phản ứng với axit clohidric: Tạo ra khí clo theo phương trình phản ứng: HClO + HCl → H2O + Cl2
– Tính oxi hóa mạnh: Sản phẩm của phản ứng này là khí clo ở điều kiện tiêu chuẩn: 2HClO + 2H+ + 2e- ⇔ Cl2 + 2H2O
– Muối của HClO: Hypochlorit nổi bật nhất là NaClO, được sử dụng rộng rãi trong chất tẩy rửa.
HClO được ứng dụng rộng rãi trong đời sống, như trong việc tẩy trắng, khử mùi, diệt khuẩn, xử lý nước thải, và khử trùng bể bơi. Nó cũng tham gia vào các quá trình chuyển hóa hữu cơ, đặc biệt là quá trình kích hoạt bạch cầu trung tính và xử lý thực phẩm trong ngành công nghiệp thực phẩm. Mặc dù HClO được sử dụng phổ biến trong cuộc sống hàng ngày, tuy nhiên, ít người hiểu rõ về tác động có hại của nó đối với sức khỏe con người.
Với một lượng HClO đủ lớn, có thể tạo ra tác động có hại đối với sức khỏe nếu tiếp xúc trực tiếp với phổi, mắt, dạ dày hoặc da của bạn. HClO, là một hợp chất oxy hóa mạnh, có thể gây kích ứng, gây bỏng, viêm nhiễm hoặc gây tổn thương cho các mô sống.
5. Tính chất của HCl:
HCl ở trong dạng khí không màu, có mùi xốc, trọng lượng nặng hơn không khí và hòa tan mạnh mẽ trong nước, tạo ra dung dịch HCl có tính axit mạnh. Khi ở trạng thái lỏng, axit HCl là một dung dịch loãng không màu, có khả năng bay hơi, nhưng không dễ cháy. Nồng độ axit HCl đậm đặc tối đa là 40%, và dung dịch có màu vàng nhạt. Trong môi trường không khí ẩm, có khả năng hình thành sương mù axit.
Tính chất hoá học của HCl bao gồm các đặc điểm của một axit mạnh như:
– Làm đổi màu quỳ tím: Khi quỳ tím nhúng vào dung dịch axit, quỳ tím chuyển màu từ màu tự nhiên sang màu đỏ.
– Tác dụng với kim loại nằm trước hidro, tạo thành muối và hidro.
– Tương tác với oxit kim loại để tạo thành muối clorua và nước.
– Phản ứng với bazơ, tạo thành muối clorua và nước.
– Tác động với muối để tạo ra muối mới và axit mới.
– Tương tác với các hợp chất có tính oxi hóa, thể hiện tính khử.
Axit HCl không tác dụng với kim loại nằm sau hidro trong dãy điện hoá, không phản ứng với các phi kim, axit, oxit kim loại và oxit phi kim.
6. Bài tập và lời giải:
Câu 1. Trong phản ứng Cl2 + H2O ⇄ HCl + HClO. Vai trong của clo là
A. chất khử.
B. chất oxi hóa, chất khử.
C. chất oxi hóa.
D. không là chất oxi hóa, chất khử.
Lời giải:
Câu 2. Khi dẫn khí clo vào nước xảy ra hiện tượng
A. hoá học
B. vật lí và hoá học
C. vật lí
D. không xảy ra hiện tượng vật lí và hóa học
Lời giải:
Câu 3. Hợp chất nào sau đây phản ứng được với nước Clo
A. NaCl
B. CaSO4
C. Cu(NO3)2
D. KOH
Lời giải:
Câu 4. Nước clo có tính tẩy màu vì
A. khi dẫn khí clo vào nước không xảy ra phản ứng hoá học
B. clo tác dụng với nước tạo nên axit HCl có tính tẩy màu
C. clo hấp phụ được màu
D. clo tác dụng nước tạo nên axit HClO có tính tẩy màu
Lời giải:
Nước clo có tính tẩy màu vì clo tác dụng nước tạo nên axit HClO có tính tẩy màu


















