Khi nhiệt phân hoàn toàn Fe(NO3)2 trong không khí thu được chất gì? Phản ứng nhiệt phân Fe(NO3)2 hay Fe(NO3)2 nhiệt độ thuộc loại phản ứng phân hủy, phản ứng oxi hóa khử. Dưới đây là kiến thức lý thuyết và một số bài tập có liên quan về phản ứng nhiệt phân hoàn toàn Fe(NO3) có lời giải. Mời các bạn đọc đón xem.
Mục lục bài viết
- 1 1. Nhiệt phân hoàn toàn Fe(NO3)2 trong không khí thu được chất gì?
- 2 2. Tìm hiểu phản ứng hóa học 4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2:
- 2.1 2.1. Điều kiện xảy ra phản ứng hóa học 4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2:
- 2.2 2.2. Dấu hiệu nhận biết xảy ra phản ứng hóa học 4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2:
- 2.3 2.3. Thực hiện phản ứng hóa học 4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2:
- 2.4 2.4. Cân bằng phương trình hóa học 4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2:
- 2.5 2.5. Ứng dụng của phản ứng hóa học 4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2:
- 3 3. Bài tập vận dụng liên quan:
1. Nhiệt phân hoàn toàn Fe(NO3)2 trong không khí thu được chất gì?
Câu hỏi: Nhiệt phân hoàn toàn Fe(NO3)2 trong không khí thu được?
A. FeO, NO2, O2
B. Fe2O3, NO2
C. Fe2O3, NO2, O2
D. Fe, NO2, O2
Đáp án: C. Fe2O3, NO2, O2
Giải thích:
Khi nhiệt phân hoàn toàn Fe(NO3)2 trong không khí, phản ứng sẽ tạo ra sắt(III) oxit (Fe2O3), khí nitơ đioxit (NO2), và khí oxy (O2).
Phương trình hóa học: 4Fe(NO3)2 t⁰ >2Fe2O3 + 8NO2 + O2
Phản ứng này xảy ra do sự oxi hóa của Fe(NO3)2 khi tiếp xúc với nhiệt độ cao trong không khí, dẫn đến việc giải phóng NO2 và O2. Sản phẩm Fe2O3 được hình thành từ sự kết hợp của Fe và O2 còn lại sau phản ứng.
* Lưu ý: Nhiệt phân muối nitrat kim loại:
– Muối nitrat đứng trước Mg nhiệt phân tạo muối nitrit và O2
Ví dụ: 2KNO3 t⁰ > 2KNO2 + O2
– Muối nitrat của kim loại từ Mg → Cu nhiệt phân tạo oxit kim loại, NO2 (nâu đỏ), O2
Ví dụ: 2Cu(NO3)2 t⁰ > 2CuO + 4NO2 + O2
– Muối đứng sau Cu nhiệt phân ra kim loại, NO2, O2
Ví dụ: 2AgNO3 t° > 2Ag + 2NO2 + O2
→ Lựa chọn C là đáp án chính xác cho câu hỏi này.
2. Tìm hiểu phản ứng hóa học 4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2:
Phản ứng nhiệt phân Fe(NO3)2 trong không khí diễn ra theo các bước sau: Khi Fe(NO3)2 được đun nóng, nó phân hủy thành Fe2O3 và khí NO2.
Phản ứng hóa học được mô tả bởi phương trình: 4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2, là một phản ứng nhiệt phân.
Trong quá trình này, các nguyên tử oxy từ không khí sẽ phản ứng với sắt để tạo thành Fe2O3, trong khi đó, nhóm nitrat (NO3) bị phân hủy tạo thành NO2 và O2. Khí O2 được giải phóng có thể tiếp tục tham gia vào các phản ứng khác hoặc được giải phóng vào không khí. Đây là một phản ứng oxi hóa-khử, trong đó sắt chuyển từ trạng thái oxi hóa +2 sang +3, và nitơ từ +5 xuống +4.
2.1. Điều kiện xảy ra phản ứng hóa học 4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2:
Phản ứng hóa học giữa 4Fe(NO3)2 và nhiệt độ cao tạo ra 2Fe2O3, 8NO2 và O2 là một phản ứng phân hủy nhiệt động, diễn ra khi nhiệt độ đủ cao để cung cấp năng lượng kích hoạt cần thiết cho quá trình phân hủy các liên kết trong phân tử Fe(NO3)2. Nhiệt độ cần thiết cho phản ứng này thường rất cao, có thể lên tới hàng trăm hoặc thậm chí hàng nghìn độ C. Điều này giúp cung cấp đủ năng lượng để vượt qua hàng rào năng lượng kích hoạt và cho phép các electron trong các nguyên tử sắt và nitơ tái sắp xếp, tạo thành các sản phẩm mới.
Trong quá trình phản ứng, sắt nitrat (Fe(NO3)2) bị oxi hóa thành sắt oxit (Fe2O3), một chất rắn màu nâu đỏ, trong khi giải phóng khí nitơ dioxit (NO2), một chất khí màu nâu đỏ có mùi khai và oxy (O2), một chất khí không màu. Sự thay đổi này không chỉ là kết quả của sự thay đổi về nhiệt độ mà còn do sự tái sắp xếp của các electron và nguyên tử trong các phân tử.
Phản ứng này không chỉ quan trọng trong lĩnh vực công nghiệp, nơi nó được sử dụng để sản xuất sắt oxit dùng trong sản xuất thép, mà còn trong lĩnh vực nghiên cứu khoa học, như việc tìm hiểu về các quá trình oxi hóa và phân hủy. Ngoài ra, việc hiểu biết về điều kiện xảy ra phản ứng cũng có thể giúp chúng ta tối ưu hóa các quá trình công nghiệp và giảm thiểu tác động tiêu cực tới môi trường.
2.2. Dấu hiệu nhận biết xảy ra phản ứng hóa học 4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2:
– Khi 4Fe(NO3)2 được nung nóng ở nhiệt độ cao, phản ứng hóa học xảy ra tạo thành 2Fe2O3 (sắt(III) oxit), 8NO2 (nitơ dioxit), và O2 (oxy).
– Sự thay đổi màu sắc có thể quan sát được khi chất rắn ban đầu màu xám của Fe(NO3)2 chuyển sang màu đỏ nâu của Fe2O3.
– Sự hình thành chất rắn mới là Fe2O3 được xác nhận qua các phương pháp phân tích hóa học.
– Sự giải phóng khí NO2 được nhận biết qua mùi khí đặc trưng và màu nâu đỏ của khí thoát ra.
2.3. Thực hiện phản ứng hóa học 4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2:
Các bước thực hiện phản ứng hóa học của 4Fe(NO3)2 khi nhiệt phân là một quá trình phức tạp và cần được tiến hành một cách cẩn thận để đảm bảo an toàn và hiệu quả.
– Đầu tiên, cần chuẩn bị một lượng chất phản ứng Fe(NO3)2 đủ cho phản ứng.
– Sau đó, chất này được đun nóng ở nhiệt độ cao hơn để phản ứng có thể xảy ra.
– Khi nhiệt độ đạt ngưỡng cần thiết, phản ứng sẽ bắt đầu và sản phẩm của phản ứng là Fe2O3, NO2 và O2 sẽ được tạo ra.
– Quá trình này cần được giám sát chặt chẽ để kiểm soát nhiệt độ và áp suất trong suốt quá trình phản ứng, nhằm tránh các nguy cơ có thể xảy ra.
2.4. Cân bằng phương trình hóa học 4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2:
– Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hoá, từ đó xác định chất oxi hoá – chất khử:
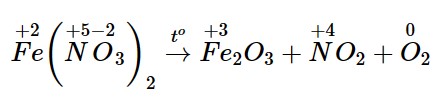
Đây là phản ứng oxi hoá – khử nội phân tử; Fe(NO3)2 vừa là chất khử, vừa là chất oxi hoá.
– Bước 2: Biểu diễn quá trình oxi hoá, quá trình khử
+ Quá trình oxi hoá: 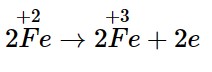
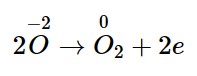
Cộng hai vế với nhau ta được: 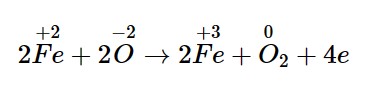
+ Quá trình khử: ![]()
– Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hoá
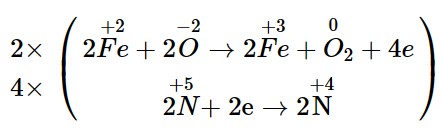
– Bước 4: Điền hệ số của các chất có mặt trong phương trình hoá học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
![]()
2.5. Ứng dụng của phản ứng hóa học 4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2:
Ứng dụng của phản ứng hóa học 4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2 trong đời sống rất đa dạng và quan trọng.
– Thường được sử dụng trong các quá trình công nghiệp như sản xuất thép và luyện kim. Sắt oxit có thể được sử dụng làm chất xúc tác, trong khi nitơ dioxit và oxy có vai trò quan trọng trong việc xử lý khí thải và làm sạch môi trường.
– Ngoài ra, phản ứng này cũng có thể được áp dụng trong lĩnh vực nông nghiệp để sản xuất phân bón chứa nitrat, giúp cung cấp dinh dưỡng cho cây trồng.
– Fe2O3 có thể được sử dụng như một chất xúc tác trong các phản ứng khác hoặc như một thành phần trong các loại sơn chống gỉ.
3. Bài tập vận dụng liên quan:
Câu 1: Trong các nhận xét dưới đây, nhận xét nào về muối nitrat của kim loại là không đúng?
A. Các muối nitrat đều là chất điện li mạnh, khi tan trong nước phân li ra cation kim loại và anion nitrat.
B. Các muối nitrat chỉ được sử dụng làm phân bón hóa học trong nông nghiệp.
C. Các muối nitrat đều dễ bị phân hủy bởi nhiệt.
D. Tất cả các muối nitrat đều dễ tan trong nước.
Đáp án: B. Các muối nitrat chỉ được sử dụng làm phân bón hóa học trong nông nghiệp.
Giải thích: Muối nitrat được giống như một chất nguyên liệu trong: phân bón, nghề làm pháo hoan nguyên liệu của bom khói, chất bảo quản và như một tên lửa đẩy, cũng như thủy tinh và men gốm.
Câu 2: Nhiệt phân hoàn toàn KNO3 thu được sản phẩm
A. K, NO2, O2.
B. KNO2, O2, NO2.
C. KNO2, O2.
D. K2O, N2O.
Đáp án: C. KNO2, O2.
2KNO3 t⁰ > 2KNO2 + O2
Câu 3: Cho ít bột Fe vào dung dịch AgNO3 dư, sau khi kết thúc thí nghiệm thu được dung dịch X gồm:
A. Fe(NO3)2, H2O
B. Fe(NO3)3, AgNO3 dư.
C. Fe(NO3)2, AgNO3 dư
D. Fe(NO3)2, Fe(NO3)3, AgNO3 dư.
Đáp án: B. Fe(NO3)3, AgNO3 dư.
Giải thích:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓
Fe(NO3)2 + AgNO3 dư → Fe(NO3)3 + Ag↓
→ Dung dịch X gồm Fe(NO3)3, AgNO3
Câu 4: Ở điều kiện thường Fe phản ứng với dung dịch nào sau đây:
A. FeCl3.
B. ZnCl2.
C. NaCl.
D. MgCl2.
Đáp án: A. FeCl3.
Giải thích:
Fe + 2FeCl3 → 3FeCl2
Câu 5: Quặng nào sau đây giàu sắt nhất?
A. Pirit sắt FeS2
B. Hematit đỏ Fe2O3
C. Manhetit Fe3O4
D. Xiđerit FeCO3
Đáp án: C. Manhetit Fe3O4
Giải thích:
Quặng giàu sắt nhất là manhetit Fe3O4 với hàm lượng sắt khoảng 72,4%