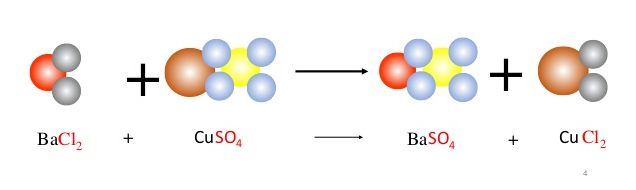
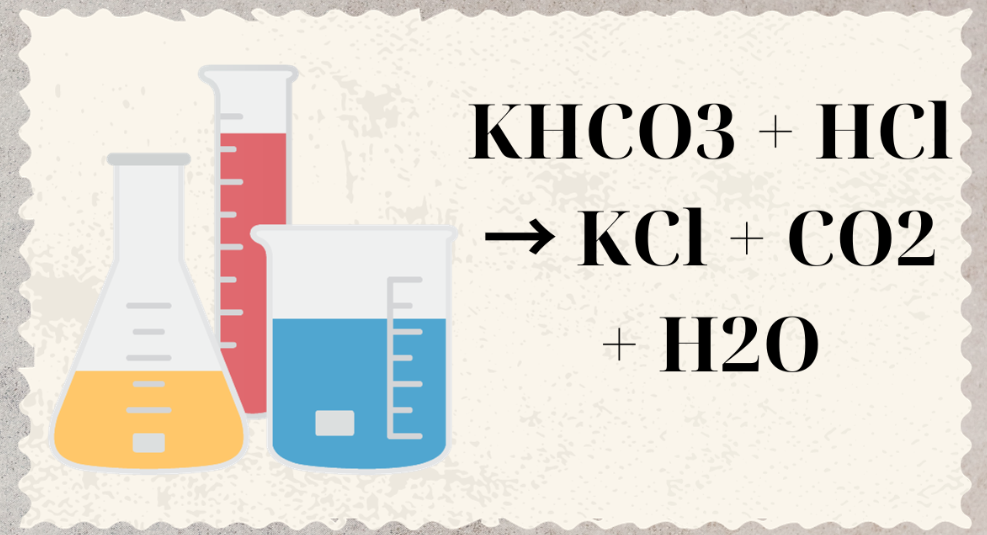
Mục lục bài viết
1. Phương trình phản ứng NaHCO3 + HCl → NaCl + CO2 + H2O:
Phương trình phản ứng được viết như sau:
NaHCO3 + HCl → NaCl + CO2 + H2O
Trong phản ứng này, sodium bicarbonate (NaHCO3) phản ứng với hydrochloric acid (HCl) để tạo ra sodium chloride (NaCl), carbon dioxide (CO2), và water (H2O). Đây là một phản ứng trao đổi khí.
Xin lưu ý rằng trong thực tế, phản ứng này sẽ tạo ra nhiều chất khí CO2 thoát ra.
2. Điều kiện phản ứng xảy ra NaHCO3 + HCl → NaCl + CO2 + H2O:
Phản ứng trên là phản ứng trao đổi, trong đó natri hidrocarbonat (NaHCO3) phản ứng với axit clohidric (HCl) để tạo thành muối natri clorua (NaCl), khí cacbonic (CO2) và nước (H2O).
Công thức phản ứng hoá học đầy đủ là: 2 NaHCO3 + 2 HCl → 2 NaCl + CO2 + 2 H2O
Điều kiện phản ứng xảy ra là cần có sự tiếp xúc giữa NaHCO3 và HCl. Nhiệt độ cũng có thể ảnh hưởng đến tốc độ phản ứng, nhưng phản ứng này có thể xảy ra ở nhiệt độ phòng.
Lưu ý rằng phản ứng trên là phản ứng hoá học và chỉ áp dụng trong điều kiện phòng hoặc trong môi trường thích hợp để tiến hành thí nghiệm. Việc thực hiện phản ứng hoá học đòi hỏi sự chú ý và kiến thức về an toàn, vì vậy nếu bạn không có kinh nghiệm thí nghiệm hoặc không đủ hiểu biết, hãy tham khảo ý kiến và sự hướng dẫn của một chuyên gia hoặc giáo viên.
3. Hiện tượng phản ứng giữa NaHCO3 + HCl → NaCl + CO2 + H2O:
Phản ứng giữa natri hidrocacbonat (NaHCO3) và axit clohidric (HCl) là một phản ứng trao đổi ion. Phản ứng có thể được viết như sau:
NaHCO3 + HCl → NaCl + CO2 + H2O
Trong phản ứng này, natri hidrocacbonat (NaHCO3) tác dụng với axit clohidric (HCl) để tạo ra muối natri clorua (NaCl), khí carbon dioxide (CO2) và nước (H2O).
NaHCO3 + HCl → NaCl + CO2 + H2O
Đây là một phản ứng axit-baz trong đó HCl là một axit mạnh và NaHCO3 là một baz yếu. Khi phản ứng xảy ra, HCl tạo thành ion Cl- và H+, trong khi NaHCO3 tạo thành ion Na+ và các ion bicarbonate (HCO3-). Các ion này sau đó tương tác và tạo ra muối NaCl, khí CO2 và nước.
Muối NaCl là muối hòa tan trong nước và tồn tại dưới dạng các ion Na+ và Cl-. Khí CO2 được giải phóng trong quá trình này, tạo thành các phân tử CO2 khí. Nước được tạo ra từ phản ứng này là nước thông thường (H2O).
Tóm lại, phản ứng giữa NaHCO3 và HCl tạo ra muối NaCl, khí CO2 và nước.
4. Phương trình rút gọn của NaHCO3 + HCl → NaCl + CO2 + H2O:
Phương trình hóa học rút gọn cho phản ứng NaHCO3 + HCl → NaCl + CO2 + H2O là:
NaHCO3 + HCl → NaCl + CO2 + H2O
5. Bài tập vận dụng liên quan:
Mở rộng kiến thức về NaHCO3 (natri bicacbonat)
Tính chất
– NaHCO3 là chất rắn, màu trắng, dễ tan trong nước.

– NaHCO3 dễ bị nhiệt phân hủy tạo thành Na2CO3 và khí CO2:
– NaHCO3 có tính lưỡng tính (vừa tác dụng với dung dịch axit, vừa tác dụng với dung dịch bazơ)
NaHCO3 + HCl → NaCl + CO2 ↑ + H2O
NaHCO3 + NaOH → Na2CO3 + H2O
Ứng dụng
NaHCO3 được dùng trong công nghiệp dược phẩm (chế tạo thuốc đau dạ dày …) và công nghiệp thực phẩm (làm bột nở …).
Kiến thức về axit clohidric HCl
Tính chất vật lí
– Hiđro clorua tan vào nước tạo thành dung dịch axit clohiđric.
– Axit clohiđric là chất lỏng, không màu, mùi xốc.
– Dung dịch HCl đặc nhất (ở 20oC) đạt tới nồng độ 37% và có khối lượng riêng D = 1,19 g/cm3.
– Dung dịch HCl đặc “bốc khói” trong không khí ẩm. Đó là do hiđro clorua thoát ra tạo với hơi nước trong không khí thành những hạt dung dịch nhỏ như sương mù.
Tính chất hóa học
Axit clohiđric là một axit mạnh, mang đầy đủ tính chất hóa học của một axit như:
– Làm quỳ tím chuyển sang màu đỏ.
– Tác dụng với kim loại đứng trước (H) trong dãy hoạt động hóa học của kim loại.
Ví dụ:
Mg + 2HCl → MgCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
Chú ý: Kim loại có nhiều hóa trị tác dụng với dung dịch HCl thu được muối trong đó kim loại ở mức hóa trị thấp. Ví dụ:
Fe + 2HCl → FeCl2 + H2
– Tác dụng với oxit bazơ và bazơ tạo thành muối và nước. Ví dụ:
CuO + 2HCl →to”>→ CuCl2 + H2O
Fe2O3 + 6HCl →to”>→ 2FeCl3 + 3H2O
NaOH + HCl → NaCl + H2O
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
– Tác dụng với muối của axit yếu hơn tạo thành muối mới và axit mới. Ví dụ:
CaCO3 + 2HCl → CaCl2 + H2O + CO2 ↑
AgNO3 + HCl → AgCl↓ + HNO3
Ngoài tính chất đặc trưng là tính axit, dung dịch axit HCl đặc còn thể hiện tính khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2Cr2O7, MnO2, KClO3…
. Điều chế
a) Trong phòng thí nghiệm
– Điều chế hiđro clorua bằng cách cho tinh thể NaCl vào dung dịch H2SO4 đậm đặc và đun nóng (phương pháp sunfat) rồi hấp thụ vào nước để được axit clohiđric.
– Phương trình hóa học minh họa:
2NaCltt + H2SO4 đặc →t0≥400o”>→ Na2SO4 + 2HCl ↑
NaCltt + H2SO4 đặc →t0≤250o”>→ NaHSO4 + HCl ↑
b) Trong công nghiệp
– Phương pháp tổng hợp: Đốt H2 trong khí quyển Cl2
H2 + Cl2 →t0″>→ 2HCl
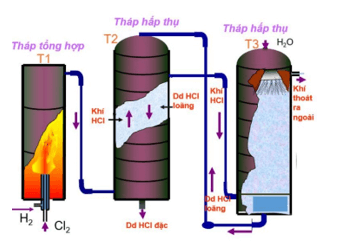
– Phương pháp sunfat: Công nghệ sản xuất từ NaCl rắn và H2SO4 đặc:
2NaCltt + H2SO4 đặc Na2SO4 + 2HCl ↑
- Ngoài ra một lượng lớn HCl thu được trong công nghiệp từ quá trình clo hóa các hợp chất hữu cơ.
Cách cân bằng phương trình NaHCO3 + HCl → NaCl + CO2 + H2O:
Phương trình ion thu gọn của phản ứng NaHCO3 tác dụng với HCl
Bước 1: Viết phương trình phân tử:
NaHCO3 + HCl → NaCl + CO2↑ + H2O
Bước 2: Chuyển các chất vừa dễ tan, vừa điện li mạnh thành ion; Các chất kết tủa, chất khí, chất điện li yếu để nguyên dưới dạng phân tử ta được phương trình ion đầy đủ:
Na+ + HCO3– + H+ + Cl– → Na+ + Cl– + CO2↑ + H2O
Bước 3: Lược bỏ đi các ion giống nhau ở 2 vế ta được phương trình ion rút gọn:
HCO3– + H+ → CO2↑ + H2O
Các mẹo để cân bằng phương trình hóa học chuẩn nhất NaHCO3 + HCl → NaCl + CO2 + H2O:
Để cân bằng phương trình hóa học, bạn cần điều chỉnh số lượng các chất phản ứng và sản phẩm sao cho tỉ lệ số mol của các nguyên tử trong phương trình trở nên bằng nhau. Đây là các bước để cân bằng phương trình hóa học chuẩn nhất NaHCO3 + HCl → NaCl + CO2 + H2O:
Bước 1: Xác định số lượng nguyên tử của mỗi nguyên tố trong phương trình. Trong trường hợp này:
Trái vế trái: Na = 1, H = 1, C = 1, O = 3 Trái vế phải: Na = 1, Cl = 1, C = 1, O = 3, H = 2
Bước 2: Bắt đầu bằng cách cân bằng số lượng nguyên tử của các nguyên tố chưa cân bằng. Trong trường hợp này, chỉ có Cl chưa cân bằng.
Bước 3: Cân bằng số lượng Cl trên cả hai vế bằng cách thêm hệ số phù hợp vào các chất phản ứng và sản phẩm. Ta cần thêm hệ số 2 trước HCl để cân bằng số lượng Cl. Phương trình trở thành:
NaHCO3 + 2HCl → NaCl + CO2 + H2O
Bước 4: Kiểm tra lại số lượng nguyên tử của mỗi nguyên tố và chắc chắn rằng phương trình đã được cân bằng.
Trái vế trái: Na = 1, H = 2, C = 1, O = 3 Trái vế phải: Na = 1, Cl = 2, C = 1, O = 3, H = 2
Bước 5: Kiểm tra lại các hệ số phần trăm nhỏ nhất. Trong trường hợp này, không có hệ số nhỏ hơn 1, vì vậy phương trình đã được cân bằng chuẩn nhất.
Phương trình hóa học cân bằng chuẩn nhất là: NaHCO3 + 2HCl → NaCl + CO2 + H2O.
Cách giải phương trình NaHCO3 + HCl → NaCl + CO2 + H2O:
Phương trình hóa học bạn đưa ra là một phản ứng trao đổi, trong đó sodium bicarbonate (NaHCO3) và hydrochloric acid (HCl) tác dụng với nhau để tạo ra sodium chloride (NaCl), carbon dioxide (CO2), và water (H2O). Đây là phản ứng trung hòa axit.
Cách giải phương trình này là sử dụng quy tắc cân bằng phương trình hóa học. Đầu tiên, chúng ta cần cân bằng số nguyên tử cho mỗi nguyên tố trên cả hai phía của phương trình.
Phía trái của phản ứng: NaHCO3 + HCl
Phía phải của phản ứng: NaCl + CO2 + H2O
Bây giờ, chúng ta sẽ bắt đầu cân bằng phương trình bằng cách thay đổi các hệ số phía trước các phân tử cho đến khi số nguyên tử của mỗi nguyên tố được cân bằng.
NaHCO3 + HCl → NaCl + CO2 + H2O
Để cân bằng số nguyên tử của natri (Na), chúng ta cần đặt hệ số 2 phía phải của NaCl.
NaHCO3 + HCl → 2NaCl + CO2 + H2O
Tiếp theo, chúng ta cân bằng số nguyên tử của cacbon (C) và hydro (H). Chúng ta cần đặt hệ số 2 phía trái của HCl và 1 phía phải của CO2.
NaHCO3 + 2HCl → 2NaCl + CO2 + H2O
Cuối cùng, chúng ta cân bằng số nguyên tử của oxi (O). Để làm điều này, chúng ta cần đặt hệ số 2 phía phải của H2O và 2 phía phải của NaHCO3.
2NaHCO3 + 2HCl → 2NaCl + CO2 + 2H2O
Vậy, phương trình đã được cân bằng và có dạng:
2NaHCO3 + 2HCl → 2NaCl + CO2 + 2H2O
Câu 1:Nhỏ từ từ từng giọt đến hết 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được số mol CO2 là
A.0,020.B.0,030.C.0,015.D.0,010.
Đáp án D
Câu 2: Cho từ từ dung dịch chứa a mol HCl vào dung dịch X chứa b mol Na2CO3 đồng thời khuấy đều, thu dược V lít khí (đktc) và dung dịch Y. Khi cho dư nước vôi trong vào dung dịch Y thấy xuất hiện kết tủa. Biểu thức liên hệ giữa V với a và b là?
A. V = 22,4(a – b) B. V = 11,2(a – b)
C. V = 11,2(a + b) D. V = 22,4( a + b)
Đáp án A
Câu 3: Cho hỗn hợp các kim loại kiềm Na, K hòa tan hết vào nước được dung dịch A và 0,672 lít khí H2 (đktc). Thể tích dung dịch HCl 0,1M cần để trung hòa hết một phần ba dung dịch A là
A. 100 ml. B. 200 ml. C. 300 ml. D. 600 ml.
Đáp án A
Câu 4: Muối được dùng để chế thuốc chữa đau dạ dày do thừa axit trong dạ dày là
A. Na2CO3. B. NaHCO3. C. NH4HCO3. D. NaF.
Đáp án B
Muối NaHCO3 có khả năng trung hòa axit trong dạ dày
NaHCO3 + HCl → NaCl + H2O + CO2↑”>↑