Bài viết dưới đây của chúng minh sẽ giúp bạn đọc có thể cân bằng phản ứng hóa học NaBr + AgNO3 → AgBr + NaNO3 một cách dễ dàng với đầy đủ điều kiện.
Mục lục bài viết
1. Khái niệm:
1.1. AgBr là gì?
AgBr là công thức hóa học của bạc bromua, là một hợp chất vô cơ bao gồm các nguyên tố bạc (Ag) và brom (Br). Nó là chất rắn màu trắng đến vàng nhạt, không hòa tan trong nước và dung dịch muối ở nhiệt độ thấp, nhưng hòa tan trong phân hữu cơ như amoniac và kali xyanua. AgBr có nhiều ứng dụng trong truyền hình ảnh, sản xuất điện tử, xử lý nước và nhiều ứng dụng khác.
1.2. NaNO3 là gì?
NaNO3 là công thức của một hợp chất hóa học có tên là natri nitrat, còn được gọi là muối Chile hoặc muối Peru. Hóa chất này là chất rắn màu trắng hòa tan tốt trong nước.
Hóa chất natri nitrat được sử dụng trong nhiều lĩnh vực quan trọng như hóa chất nguyên liệu trong khoa, pháo hoa, bom khói, hóa chất tinh khiết dùng trong phòng thí nghiệm làm chất bảo quản, phóng tên lửa, thủy tinh hay men công trường.
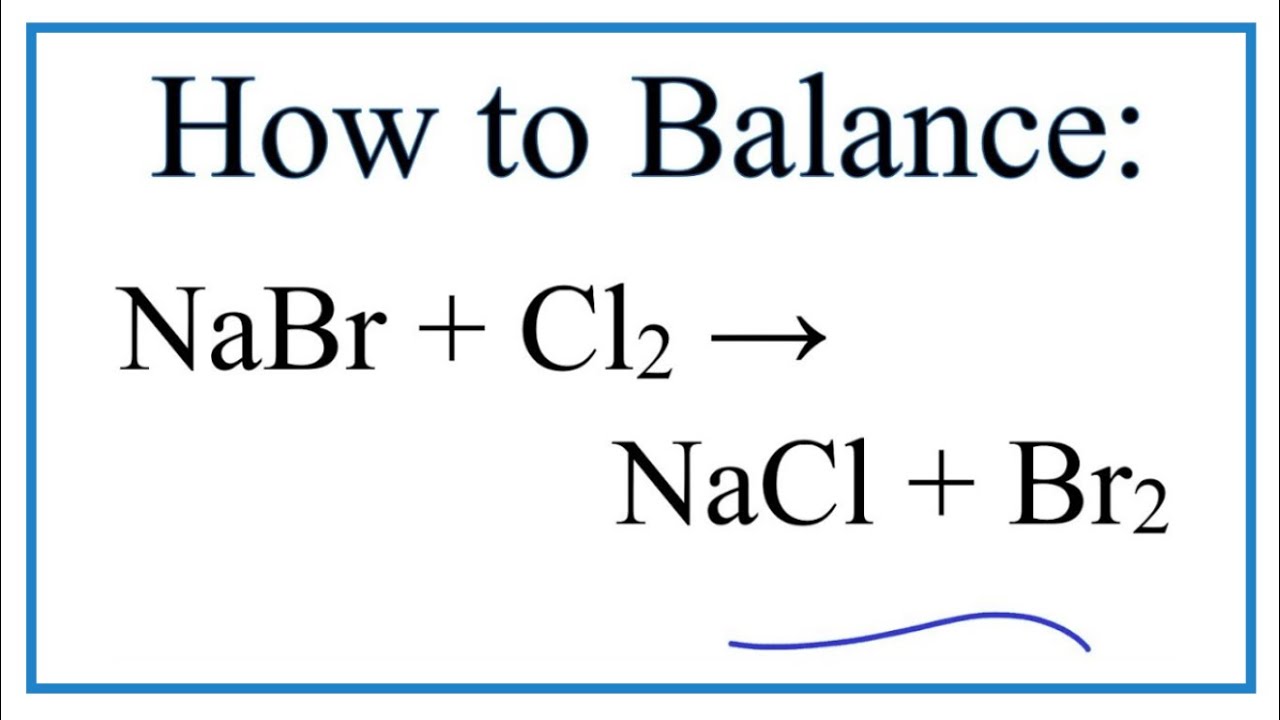
2. Phương trình phản ứng NaBr + AgNO3 → AgBr + NaNO3:
NaBr + AgNO3 → AgBr + NaNO3
– Điều kiện phản ứng xảy ra giữa phản ứng NaBr và AgNO3:
Phản ứng trên xảy ra Ở nhiệt độ thường
– Cách thực hiện phản ứng
+ nhỏ dung dịch AgNO3 vào ống nghiệm chứa NaBr.
– Hiện tượng nhận biết phản ứng
+ Có kết tủa vàng nhạt.
3. Ví dụ minh họa:
Ví dụ 1:
Chất nào sau đây không thể phản ứng với AgNO3?
A. HF. B. NaBr. C. HBr. D, KI.
Hướng dẫn giải
HF không phản ứng với AgNO3.
Đáp án A.
Ví dụ 2:
nhỏ từ từ một vài giọt NaBr vào ống nghiệm có chứa 1ml AgNO3 thu được kết tủa có màu
A. trắng. B. vàng nhạt. C. vàng đậm. D. nâu đỏ.
Hướng dẫn giải
NaBr + AgNO3 → NaNO3 + AgBr (↓)
AgBr: kết tủa vàng nhạt.
Đáp án B.
Ví dụ 3:
Khối lượng kết tủa thu được khi cho NaBr phản ứng vừa đủ với 100ml AgNO3 0,1M là
A. 14,35g. B. 1,88g. C.1,44g. D. 2,00g
Hướng dẫn giải
Đáp án B.
4. Câu hỏi vận dụng liên quan:
Câu 1. Phát biểu nào sau đây đúng?
A. Không tồn tại đồng thời cặp chất NaF và AgNO3
B. Iot có bán kính nguyên tử lớn hơn brom
C. Axit HBr có tính axit yếu hơn axit HCl
D. Flo có tính oxi hoá yếu hơn Clo
Xem đáp án
Câu 2. Để phân biệt khí O2 và O3 có thể dùng:
A. dung dịch KI
B. Hồ tinh bột
C. dung dịch KI có hồ tinh bột
D. dung dịch NaOH
Xem đáp án
Câu 3. Đổ dung dịch AgNO3 lần lượt vào 4 dung dịch: NaF, NaCl, NaBr và NaI thì thấy:
A. Cả 4 dung dịch đều tạo kết tủa.
B. Có 3 dung dịch tạo ra kết tủa và 1 dung dịch không tạo kết tủa.
C. Có 2 dung dịch tạo ra kết tủa và 2 dung dịch không tạo kết tủa.
D. Có 1 dung dịch tạo ra kết tủa và 3 dung dịch không tạo ra kết tủa.
Xem đáp án
Câu 4. Cho dãy dung dịch axit sau HF, HCl, HBr, HI. Dung dịch có tính axit mạnh nhất và tính khử mạnh nhất là:
A. HF
B. HCl
C. HBr
D. HI
Xem đáp án
Câu 5. Tính chất nào sau đây không phải là tính chất chung của các nguyên tử halogen
A. Nguyên tử có khả năng thu thêm 1 electron
B. Tác dụng với hidro tạo thành hợp chất có liên kết cộng hóa trị có cực
C. Có số oxi hóa -1 trong mọi hợp chất
D. Lớp electron ngoài đều có 7 electron
Xem đáp án
Câu 6. Đặc điểm nào dưới đây không phải là đặc điểm chung cho các nguyên tố halogen (F, Cl, Br, I)?
A. Lớp electron ngoài cùng đều có 7 electron.
B. Nguyên tử đều có khả năng nhận thêm 1 electron.
C. Chỉ có số oxi hóa -1 trong các hợp chất.
D. Các hợp chất với hiđro đều là hợp chất cộng hóa trị.
Xem đáp án
Câu 7. Cho các phát biểu sau:
(a) Trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa;
(b) Axit flohiđric là axit yếu;
(c) Dung dịch NaF loãng được dùng làm thuốc chống sâu răng;
(d) Trong hợp chất, các halogen (F, Cl, Br, I) đều có số oxi hóa -1, +1, +3, +5, +7;
(e) Tính khử của các ion halogenua tăng dần theo thứ tự: F-, Cl-, Br-, I-.
Số phát biểu đúng là
A. 2.
B. 3
C. 4
D. 5.
Câu 8. Nhóm gồm các chất dùng để điều chế trực tiếp ra oxi trong phòng thí nghiệm là:
A. KClO3, CaO, MnO2
B. KMnO4, H2O2, KClO3
C. KMnO4, MnO2, NaOH
D. KMnO4, H2O, không khí
Xem đáp án
Câu 9. Đặc điểm nào dưới đây là đặc điểm chung của các đơn chất halogen?
A. Ở điều kịên thường là chất khí
B. Tác dụng mạnh với nước
C. Vừa có tính oxi hoá, vừa có tính khử
D. Có tính oxi hoá mạnh
Xem đáp án
Câu 10. Đổ dung dịch AgNO3 lần lượt vào 4 dung dịch: NaF, NaCl, NaBr và NaI thì thấy:
A. Cả 4 dung dịch đều tạo kết tủa.
B. Có 3 dung dịch tạo ra kết tủa và 1 dung dịch không tạo kết tủa.
C. Có 2 dung dịch tạo ra kết tủa và 2 dung dịch không tạo kết tủa.
D. Có 1 dung dịch tạo ra kết tủa và 3 dung dịch không tạo ra kết tủa.
Xem đáp án
5. Một số điều cần biết về AgBr và NaNO3:
– Cấu trúc của AgBr:
Cấu trúc của AgBr là cấu trúc ion tinh thể, trong đó ion bạc Ag+ và brom Br- tạo thành mạng tinh thể. Mỗi ion bạc Ag+ được bao quanh bởi bốn ion Br- brom và mỗi ion Br- brom được bao quanh bởi bốn ion bạc Ag+. Cấu trúc cấu trúc này rất ổn định vì các ion bạc và brom được liên kết với nhau bằng liên kết ion và được định hướng tương đối với nhau trong cấu trúc tinh thể.
Cấu trúc tinh thể của AgBr tạo ra các hạt tinh thể ổn định theo phương pháp, mỗi hạt có đường kính từ 5-10 nm, tùy thuộc vào phương pháp điều chế và điều kiện tinh chế của AgBr.
Cấu trúc này cũng giải thích tại sao AgBr kém hòa tan trong nước và phân môi trường, bởi vì các hạt tinh thể có thể hòa tan cấu trúc trong dung môi và chỉ hòa tan trong dung môi có tính chất đặc biệt. tương thích với cấu trúc của AgBr.
– Ứng dụng của AgBr trong các lĩnh vực:
AgBr có nhiều ứng dụng quan trọng trong nhiều lĩnh vực khác nhau. Dưới đây là một số ứng dụng của AgBr:
Ứng dụng trong cuộn ảnh: AgBr được dùng làm chất cảm ứng ánh sáng trong phim ảnh và giấy cuộn. Khi bắt đầu có ánh sáng chiếu vào, AgBr sẽ bị oxy hóa và chuyển thành Ag+, tạo nên các vảy bạc đen trên bề mặt phim, tạo ra hình ảnh.
Ứng dụng trong xử lý nước: AgBr có tính kháng khuẩn và làm sạch nước nên được dùng trong xử lý nước để diệt vi khuẩn, vi rút và các mầm bệnh khác.
Ứng dụng trong y tế: AgBr được sử dụng trong một số sản phẩm y tế như máy hút bụi và thuốc kháng sinh để diệt vi khuẩn và ngăn ngừa nhiễm trùng.
Ứng dụng trong sản xuất bạc: AgBr được dùng làm chất điều hòa trong sản xuất bạc để giảm áp suất hơi và giúp ngăn bạc bị oxi hóa trong quá trình sản xuất.
Ứng dụng trong thiết bị điện tử: AgBr cũng được sử dụng trong sản xuất thiết bị điện tử như điốt và cảm biến.
Ứng dụng công nghiệp: AgBr được sử dụng trong công nghiệp để sản xuất các hợp chất bạc khác nhau như AgCl, AgI và AgNO3.
Tóm lại, AgBr có nhiều ứng dụng trong giữ ảnh, xử lý nước, y tế, sản xuất bạc, thiết bị điện tử và công nghiệp.
– Ứng dụng của NaNO3trong các lĩnh vực:
Bảo quản thịt
Natri nitrat là một chất bảo vệ và giữ nhiệt hoàn toàn có thể được tìm thấy trong các loại thịt đã qua chế biến. Đây là những thực phẩm như xúc xích, xúc xích Ý, giăm bông và các loại thịt nguội khác. Natri nitrat Ngăn chặn sự phát triển của vi trùng tạo và duy trì màu đỏ của thịt. Tuy nhiên, các nhà khoa học đã phát hiện ra rằng natri nitrat cũng như các chất liệu vệ sinh, bảo vệ thực phẩm khác sẽ tiềm ẩn những nguy cơ đáng tiếc ảnh hưởng đến sức khỏe thể chất con người.
Sản xuất thủy tinh
Để tăng hiệu quả làm cho kính cường lực có khả năng chống va đập cao và không bị vỡ ngay cả khi tiếp xúc với nhiệt độ cao hay thấp nhất định, nhiều người đã sử dụng natri nitrat để gia cố mặt phẳng của kính. Và tác dụng của nó được áp dụng ở bước đầu tiên là ngâm kính trong dung dịch natri nitrat hòa tan. Thủy tinh trải qua quá trình ngâm natri nitrat có khả năng chống co ngót và giãn nở tốt hơn, đồng thời có khả năng chống hàn tốt hơn.
Phân bón
Natri nitrat có khả năng giúp cây phát triển nhanh hơn. Vì vậy, các phân vùng sử dụng natri nitrat làm thành phần. Hợp chất này chứa một lượng vừa đủ để ảnh hưởng đến sự phát triển của cây trồng. Tuy nhiên, hãy cẩn thận khi sử dụng natri nitrat vì dư lượng quá nhiều cũng không tốt cho cây trồng. Quá đầy đủ có thể làm cho cây chậm ra quả, trong khi quá ít đầy đủ có thể kìm hãm sự phát triển của cây.
Dược phẩm
Hạn chế sử dụng hóa chất natri nitrat trong dược phẩm. Nhưng có thể tìm thấy hợp chất này trong thuốc nhỏ mắt. Thông thường natri nitrat được sử dụng như một chất ức chế, không phải là thành phần chính. Đây là phần làm đầy các thành phần thiết yếu trong thuốc nhỏ mắt.
Thuốc súng
Natri nitrat là một thành phần cung cấp nhiên liệu cho tên lửa. Hóa chất này được biết là dùng để thay thế sửa chữa nitrat kali trong động cơ tên lửa phía đông. Bởi lẽ, loại hóa chất này khá rẻ (giá phải chăng hơn kali nitrat), không gây ô nhiễm và hơn nữa không thay đổi. Nhưng natri nitrat cũng có điểm yếu là vận tốc chậm như kali nitrat.