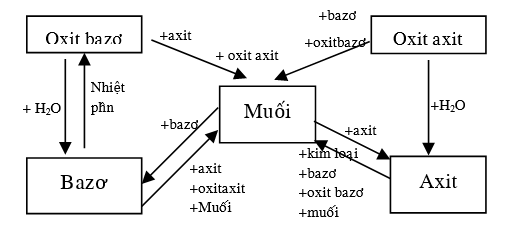
Trong phản ứng hóa học giữa axit và bazơ, hoặc oxit axit với bazơ và oxit bazơ với axit sẽ tạo thành một hợp chất được gọi là muối, chúng có giống muối chúng ta ăn hàng ngày hay không? cùng bài viết này tìm hiểu nhé:
Mục lục bài viết
1. Muối là gì?
Khi nhắc đến muối, hầu hết mỗi chúng ta đều nghĩ ngay đến muối ăn trong không gian bếp nhà mình, được sử dụng như một loại gai vị trong bữa ăn hàng ngày.
Muối trong hóa học thường đề cập đến các hợp chất ion, được tạo thành từ cặp ion dương (cation) và ion âm (anion). Cation là một ion mang điện tích dương, thường là một nguyên tố kim loại hoặc một nhóm nguyên tử mang điện tích dương, trong khi anion là một ion mang điện tích âm, thường là một nguyên tố phi kim hoặc một nhóm nguyên tử mang điện tích âm.
Một số ví dụ phổ biến về muối bao gồm:
- Muối bàn: Sodium chloride (NaCl) là một trong những ví dụ phổ biến nhất về muối. Nó được tạo ra bằng cách kết hợp ion sodium (Na⁺) và ion chloride (Cl⁻).
- Muối kẽm sulfat: Zinc sulfate (ZnSO₄) là một ví dụ khác, được tạo ra từ ion kẽm (Zn²⁺) và ion sulfate (SO₄²⁻).
- Muối magie clorua: Magnesium chloride (MgCl₂) là một muối khác, được tạo ra từ ion magie (Mg²⁺) và ion chloride (Cl⁻).
- Muối sắt sulfat: Iron sulfate (FeSO₄) được tạo thành từ ion sắt (Fe²⁺) và ion sulfate (SO₄²⁻).
Muối có nhiều ứng dụng trong cuộc sống hàng ngày và công nghiệp, từ chất làm mềm nước cho nưới và thực phẩm đến chất tạo kiểu trong công nghiệp hóa phẩm và thậm chí là làm sạch nước. Muối cũng có sử dụng trong các phản ứng hóa học và là một phần quan trọng của hóa học vô cơ.
2. Thành phần hóa học của muối:
Muối gồm có 2 thành phần chính là nguyên tử kim loại hoặc gốc amoni NH4+ kết hợp với gốc axit. Vì thành phần khác nhau nên tên gọi của các loại muối cũng có sự khác biệt phụ thuộc vào mỗi thành phần.
Tên muối = Tên kim loại (kèm theo hóa trị nếu kim loại thuộc dạng có nhiều hóa trị) + Tên gốc axit
Ví dụ:
– Fe(NO3)3 có tên gọi là Sắt (III) nitrat
– Na2SO4 có tên gọi là Natri sunfat
– Mg(NO3)2 có tên gọi là Magie nitrat
Tên gọi của những gốc axit thông dụng:
–Cl: clorua
=S: sunfua
=SO3: sunfit
=SO4: sunfat
=CO3: cacbonat
≡PO4: photphat
3. Các cách phân loại muối:
Muối có thể được phân loại theo nhiều cách khác nhau, dựa trên các yếu tố như thành phần hóa học, nguồn gốc, cấu trúc tinh thể, và ứng dụng. Dưới đây là một số cách phân loại phổ biến cho muối:
- Theo thành phần hóa học:
– Muối trung hòa: Là muối chưa gốc axit nhưng không chứa nguyên tử H mà có thể thay thế được bằng nguyên tử kim loại. Ví dụ như Na2CO3, CaCO3,…
– Muối axit: Là muối chưa gốc axit mà trong gốc axit vẫn còn tồn tại nguyên tử H chưa được thay thế bằng kim loại. Ví dụ như NaHSO4, K2HPO4,…
- Theo nguồn gốc:
– Muối tự nhiên: Muối được khai thác từ mỏ muối hoặc các nguồn muối tự nhiên khác.
– Muối biển: Muối được sản xuất bằng cách làm bay hơi nước biển, để lại muối sau khi nước bay hơi.
– Muối khoáng: Muối được khai thác từ khoáng muối trong lòng đất.
- Theo cấu trúc tinh thể:
– Muối ion: Muối có cấu trúc tinh thể trong đó cation và anion được tổ chức thành lưới lattic tinh thể. Ví dụ là muối bàn (sodium chloride).
– Muối phân tử: Muối phân tử không có cấu trúc lattic tinh thể và thường tồn tại ở dạng hạt mô của các phân tử muối. Ví dụ là muối Epsom (sulfate magie).
- Theo ứng dụng:
– Muối thực phẩm: Muối được sử dụng để nấu ăn và gia vị thực phẩm.
– Muối công nghiệp: Muối được sử dụng trong nhiều quá trình công nghiệp, chẳng hạn như làm sạch nước, sản xuất hóa chất, và làm nguội nước.
Cách phân loại muối có thể thay đổi tùy thuộc vào ngữ cảnh và mục đích cụ thể, nhưng những phân loại trên đây là những cách phân loại phổ biến.
4. Tính chất hóa học của muối:
Muối có tính chất bền vững.
– Tác dụng với kim loại tạo thành muối mới và kim loại mới:
Muối khi tác dụng với kim loại sẽ tạo thành muối mới và kim loại mới. Tuy nhiên, không phải trường hợp nào cũng có thể tạo thành kết quả như vậy, mà phản ứng chỉ xảy ra trong điều kiện kim loại tham gia (trừ các kim loại tan trong nước như Na, K, Ba, Ca, Li) mạnh hơn kim loại trong hợp chất muối.
Hãy áp dụng dãy hoạt động hóa học của kim loại để xác định tính mạnh yếu của kim loại: K > Na > Ca > Mg > Al > Zn > Fe > Ni > Sn > Pb > H > Cu > Hg > Ag > Pt > Au
Ví dụ:
Fe + CuSO4 → FeSO4 + Cu↓
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
– Tác dụng với axit tạo thành muối mới và axit mới:
Để muối khi tác dụng với axit tạo thành muối mới và axit mới, axit mới tạo thành phải yếu hơn axit tham gia phản ứng và đồng thời, muối mới cũng không tan (kết tủa) trong axit tạo thành.
Ví dụ:
BaCl2 + H2SO4 → 2HCl + BaSO4↓
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
– Tác dụng với dung dịch bazơ tạo thành muối mới và bazơ mới:
Muối có khả năng phản ứng với dung dịch bazơ (các bazơ tan) để tạo thành muối mới và bazơ mới.
Ví dụ:
Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓
NaOH + FeSO4 → Fe(OH)2 + Na2SO4
– Tác dụng với dung dịch muối tạo thành 2 muối mới:
Muối có thể tác dụng với dung dịch muối tạo thành 2 loại muối mới (sản phẩm có thể là dung dịch muối hoặc kết tủa muối). Điều kiện để phản ứng xảy ra này là muối tham gia phải tan và sản phẩm tạo thành phải có chất kết tủa.
Ví dụ:
NaCl + AgNO3 → AgCl ↓+ NaNO3
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
– Phản ứng trao đổi:
Muối khi tham gia phản ứng trao đổi: 2 hợp chất tham gia phản ứng sẽ trao đổi các thành phần hóa học với nhau để tạo ra những hợp chất mới. Phản ứng trao đổi chỉ xảy ra với điều kiện sản phẩm tạo thành có chất khí hoặc chất kết tủa.
Trong phản ứng trao đổi, số oxi hóa của các nguyên tố tham gia luôn được giữ cố định.
Ví dụ::
K2SO4 + NaOH → phản ứng không xảy ra
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓
– Phản ứng phân hủy:
Ở điều kiện nhiệt độ cao, một số loại muối sẽ tự phân hủy. Ví dụ như KMnO4, KClO3, CaCO3,…
Ví dụ:
2 KClO3 → 2 KCl + 3 O2
CaCO3 → CaO + CO2
5. Các điều chế muối ở phòng thí nghiệm và công nghiệp:
Muối có thể được điển chế thông qua nhiều phương pháp khác nhau, tùy thuộc vàp mối loại muối cần điều chế. Ví dụ như muối ăn hàng này trong hóa học có công thức là NaCl có thể khai thác từ muối mỏ, khai thác từ nước biển hoặc tinh chế.
Muối có thể được điều chế từ những phương pháp sau:
– Phương pháp trung hòa axit – bazơ. Ví dụ, để điều chế muối natri clorua (NaCl), axit clohidric (HCl) được trung hòa bằng natri hydroxit (NaOH) để tạo ra NaCl và nước. Hoặc
– Phương pháp trung hòa kiềm-axit. Ví dụ, trung hòa axit clohidric (HCl) với canxi hydroxit (Ca(OH)2) ta được muối clorua canxi (CaCl2).
– Phương pháp kết tủa. Ví dụ, muối sunfat canxi (CaSO4) có thể được điều chế bằng cách kết tủa từ dung dịch chứa ion canxi và ion sunfat.
– Phương pháp điện phân. Ví dụ, Điện phân muối natri clorua (NaCl) có thể tạo ra natri kim loại và khí clo.
– Phương pháp khử. Ví dụ, cách khử ion đồng (II) trong muối đồng clorua (CuCl2) bằng chất khử như khí hidr ta sẽ được muối đồng sunfat (CuSO4).
– Phương pháp trung hòa muối kép. Ví dụ, axit tartaric (C4H6O6) được sử dụng để trung hòa và tạo ra muối kép, điều chế muối natri tartrate (Na2C4H4O6).
– Phương pháp trao đổi ion. Ví dụ, muối sắt (II) sulfat (FeSO4) có thể được điều chế bằng cách trao đổi ion giữa muối sắt (III) clorua (FeCl3) và muối sắt (II) clorua (FeCl2) trong dung dịch.
6. Các ứng dụng quan trọng của muối:
Muối có nhiều ứng dụng quan trọng trong cuộc sống hàng ngày và trong nhiều ngành công nghiệp. Dưới đây là một số ứng dụng quan trọng của muối:
- Sử dụng trong thực phẩm: Muối là một phần quan trọng của nấu ăn và nấu nướng. Nó được sử dụng để gia vị thực phẩm, cải thiện hương vị, và bảo quản thực phẩm. Muối cũng được sử dụng để làm mềm nước đun và nấu chín thực phẩm nhanh hơn.
- Công nghiệp hóa chất: Muối được sử dụng trong sản xuất nhiều sản phẩm hóa chất như axit clohydric (HCl) và soda lạnh (sodium hydroxide).
- Làm sạch nước: Muối được sử dụng để làm sạch nước bằng cách loại bỏ các tạp chất và các ion kim loại nặng khỏi nước. Quá trình này thường được gọi là quá trình cation-exchange và anion-exchange.
- Làm mềm nước: Muối có thể được sử dụng để loại bỏ ion canxi và magie khỏi nước, làm mềm nước và ngăn ngừng tạo cặn canxi và magie trong hệ thống ống nước và máy rửa chén.
- Làm mát: Muối được sử dụng trong các hệ thống làm mát và làm lạnh để tạo ra dung dịch làm mát.
- Đường tắt đường: Muối cũng có thể được sử dụng để làm sạch và làm tươi các con đường trong thời tiết lạnh, để ngăn băng đá.
- Sản xuất hóa phẩm: Muối được sử dụng trong sản xuất nhiều loại hóa chất, chẳng hạn như muối sắt sulfate (sulfate ferrous) và muối natri cacbonat (sodium carbonate).
- Sản xuất thuốc trừ sâu: Muối có thể được sử dụng làm phụ gia trong sản xuất các loại thuốc trừ sâu.
- Các ứng dụng y tế: Muối được sử dụng trong các ứng dụng y tế như dung dịch muối sinh lý để thực hiện rửa mắt và làm sạch vết thương.
Những ứng dụng này chỉ là một số ví dụ, và muối có mặt trong nhiều khía cạnh của cuộc sống và công nghiệp, đóng vai trò quan trọng trong việc duy trì và cải thiện chất lượng cuộc sống.