Bài viết dưới đây sẽ cung cấp cho các em học sinh Lý thuyết và hướng dẫn giải bài tập Hóa 11 Bài 41: Phenol. Mong rằng sẽ giúp các em nắm vững được lý thuyết cũng như cách giải các bài tập của bài Luyện tập, cách làm đầy đủ, chi tiết và rõ ràng. Mời các bạn tham khảo trong bài viết dưới đây.
Mục lục bài viết
1. Lý thuyết Hóa học 11 Bài 41 Phenol:
Định nghĩa:
Khi thay thế nguyên tử HH trong vòng benzen bằng nhóm −OH ta được phenol.
Cần phân biệt phenol (nhóm −OH đính trực tiếp vào vòng benzen) và ancol thơm (nhóm −OH đính vào mạch nhánh của vòng benzen).
Phenol là những hợp chất hữu cơ trong phân tử có nhóm −OH liên kết trực tiếp với nguyên tử cacbon của vòng benzen. Chất tiêu biểu là phenol thường (gọi tắt là phenol).
Phân loại:
Dựa theo số nhóm −OH trong phân tử, các phenol được phân loại thành:
Phenol đơn chức: Phân tử có một nhóm −OH phenol.
Phenol đa chức: Phân tử có hai hay nhiều nhóm −OH phenol.
Cấu tạo:
Phenol có công thức phân tử C6H6O và có công thức cấu tạo C6H5OH hoặc
Mô hình phân tử phenol dạng đặc (a) và dạng rỗng (b)
Tính chất vật lí:
Ở điều kiện thường, phenol là chất rắn, không màu, nóng chảy ở 43oC. Để lâu, phenol chuyển thành màu hồng do bị oxi hoá chậm trong không khí.
Phenol rất độc. Khi dây vào tay, nó gây bỏng da, do đó khi sử dụng phenol phải hết sức cẩn thận.
Phenol rất ít tan trong nước lạnh, nhưng tan nhiều trong nước nóng và trong etanol.
Tính chất hoá học:
– Tính chất axit
Tác dụng với kim loại kiềm và bazơ kiềm. Phenol có tính axit rõ rệt, nhưng tính axit rất yếu (yếu hơn H2CO3), không làm đổi màu quỳ tím, bị CO2 đẩy ra khỏi muối phenolat.
– Phản ứng ở vòng benzen
Tác dụng với brom:
Khi cho nước brom vào dung dịch phenol, thấy xuất hiện ngay kết trắng của 2,4,6-tribromphenol:
Nhờ phản ứng này có thể phát hiện lượng rất nhỏ phenol.
Tương tự bezen, phenol có thể cộng hiđrô tạo thành xiclohaxenol:
Điều chế:
Trong công nghiệp, hiện nay phenol được điều chế bằng cách oxi hoá cumen (isopropylbenzen) nhờ oxi không khí, sau đó thuỷ phân trong dung dịch H2SO4 loãng. Sản phẩm thu được gồm phenol và axeton. Đun nóng cho axeton bay hơi rồi ngưng tụ hơi thu lấy axeton, còn lại là phenol.
Phenol cũng có thể được điều chế từ benzen theo sơ đồ:
Ngoài ra, một lượng đáng kể phenol được tách ra từ nhựa than đá trong quá trình luyện cốc.
Ứng dụng:
Phenol là nguyên liệu sản xuất nhựa phenol-fomanđehit hay poli(phenol- fomanđehit) dùng chế tạo các đồ dân dụng; nhựa ure-fomanđehit dùng làm chất kết dính (như keo dán gỗ, dán kim loại, sành, sứ…).
Phenol còn được dùng để sản xuất phẩm nhuộm, thuốc nổ (2,4,6-trinitrophenol),
chất diệt cỏ 2,4-D, chất diệt nấm mốc (nitrophenol),…
2. Trắc nghiệm Hóa học lớp 11 Bài 41 Phenol kèm đáp án:
Bài 1: Tên gọi của hợp chất có công thức cấu tạo là
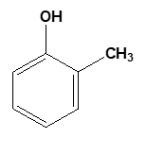
A. Phenol
B. m-crezol
C. o-crezol
D. p-crezol
Đáp án: C
Giải thích: Nhóm thế -CH3 ở vị trí ortho so với nhóm -OH nên có tên là o-crezol (hoặc 2 – metylphenol).
Bài 2: Cho hỗn hợp gồm 0,2 mol phenol và 0,3 mol etylen glycol tác dụng với lượng dư kali thu được V lít H2 ở đktc.Giá trị của V là?
A. 8,96
B. 11,2
C. 5,6
D. 7,84
Đáp án: A
Giải thích:
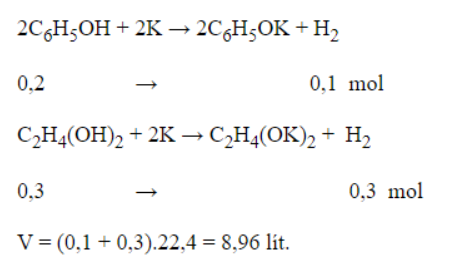
Bài 3: Ảnh hưởng của nhóm OH đến nhân benzen được chứng minh bởi phản ứng nào ?
A. Phản ứng của phenol với dung dịch NaOH
B. Phản ứng của phenol với nước Brom
C. Phản ứng của phenol với Na
D. Phản ứng của phenol với anđehit fomic.
Đáp án: B
Giải thích:
Ảnh hưởng của nhóm -OH đến nhân benzen : Nhóm -OH đẩy e vào vòng benzen làm cho mật độ điện tích âm tại vị trí o, p tăng, các tác nhân thế mang điện tích dương như Br+, NO2+ dễ tấn công vào o, p.
Chọn phản ứng với dung dịch Br2
Bài 4: Nhận xét nào sau đây đúng?
A. Phenol có tính axit mạnh hơn etanol
B. Phenol có tính axit yếu hơn etanol
C. Phenol dễ tan trong nước hơn trong dung dịch NaOH
D. Phenol không có tính axit.
Đáp án: A
Giải thích:
Loại C vì: Phenol ít tan trong nước
Loại D vì: Do ảnh hưởng của vòng benzen đến OH dẫn tới phenol có tính axit.
Loại B vì: Vòng benzen hút e của nhóm OH làm mật độ điện tích trên OH giảm, liên kết O-H phân cực mạnh hơn. Nguyên tử H của nhóm OH linh động hơn so với ancol nên phenol có tính axit mạnh hơn etanol
Bài 5: Cho 15,4 gam hỗn hợp o-crezol và etanol tác dụng với Na dư thu được m gam muối và 2,24 lít khí H2. Giá trị của m là
A. 19,8
B. 18,9
C. 17,5
D. 15,7
Đáp án: A
Giải thích:
Đặt công thức tổng quát của hỗn hợp là ROH.
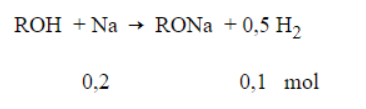
Áp dụng định luật BTKL ta có:
mROH + mNa = mmuối + mH2″>
↔ 15,4 + 0,2.23 = m + 0,1. 2
→ m = 19,8 gam
Bài 6: Hãy chọn phát biểu sai:
A. Phenol có tính axit yếu nhưng mạnh hơn H2CO3.
B. Phenol là chất rắn kết tinh dễ bị oxi hóa trong không khí.
C. Khác với benzen, phenol phản ứng dễ dàng với Br2 tạo kết tủa trắng.
D. Nhóm –OH và gốc phenyl ở phenol có ảnh hưởng qua lại lẫn nhau.
Đáp án: A
Giải thích: Phenol có tính axit yếu hơn cả H2CO3.
Bài 7: Có bao nhiêu hợp chất thơm X có công thức phân tử là C7H8O2 tác dụng NaOH theo tỉ lệ 1:2. Số công thức cấu tạo X là
A. 6
B. 8
C. 4
D. 5
Đáp án: A
Giải thích:
X là của phenol, có 2 nhóm OH liên kết trực tiếp với vòng benzen
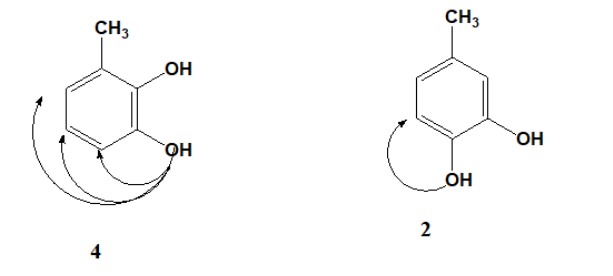
Vậy có tất cả 6 công thức thỏa mãn
Bài 8: Để phân biệt dung dịch phenol và ancol benzylic ta có thể dùng thuốc thử nào trong các thuốc thử sau: Na (1), NaOH (2), dung dịch nước Br2 (3).
A. Chỉ có (1)
B. (2) và (3)
C. Chỉ có (2)
D. Chỉ có (3)
Đáp án: D
Giải thích:
– Dung dịch phenol tác dụng với NaOH và dung dịch nước Br2 còn ancol benzylic thì không.
– Tuy nhiên phản ứng giữa dung dịch phenol và dung dịch NaOH không quan sát rõ được hiện tượng phản ứng. Còn phản ứng giữa dung dịch phenol và dung dịch brom dễ dàng quan sát được hiện tượng hóa học xảy ra.
Bài 9: Chiều giảm dần độ linh động của nguyên tử H (trái sang phải) trong nhóm OH của 3 hợp chất: C6H5OH (1), etanol (2), 2-nitro phenol (3)
A. (1) < (2) < (3)
B. (2) < (1) < (3)
C. (3) < (2) < (1)
D. (2) < (3) < (1)
Đáp án: B
Giải thích:
Etanol không có sự tác động của nhân benzen nên tính axit yếu nhất
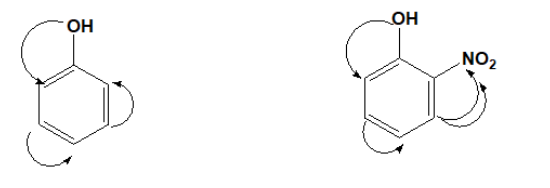
Nhân benzen chứa nhóm NO2 hút e mạnh hơn dẫn tới liên kết H-O phân cực mạnh hơn nên tính axit của (3) > (2)
Câu 10: 0,54 gam 1 đồng đẳng của phenol phản ứng vừa đủ với 10ml NaOH 0,5M. Công thức phân tử của chất ban đầu là :
A. C7H8O
B. C7H8O2
C. C8H10O
D. C8H10O2
Đáp án: A
Giải thích:
nNa = 0,5.0,01=0,005 (mol)
Gọi đồng đẳng của phenol có công thức là ROH
ROH + NaOH →”>→ RONa + H2O
0,005 0,005
MROH = 0,540,005=108″>0,540,005=108 = R+ 17
→ R = 91
Vậy hợp chất có công thức: C7H8O.
3. Bài tập vận dụng có lời giải:
Bài 1:
Cho các phát biểu sau đúng hay sai? Giải thích tại sao?
(1) Phenol tan vô hạn trong nước ở 660C.
(2) Phenol có lực axit mạnh hơn ancol etylic.
(3) Phản ứng thế vào benzen dễ hơn phản ứng thế vào nhân thơm của phenol.
(4) Phenol tan tốt trong etanol.
(5) Phenol làm quí tím hóa đỏ.
(6) Phenol phản ứng được với Brom ở điều kiện thường.
Hướng dẫn:
(1) Phenol tan vô hạn trong nước ở 660C. ⇒ Đúng.
(2) Phenol có lực axit mạnh hơn ancol etylic. ⇒ Đúng.
(3) Phản ứng thế vào benzen dễ hơn phản ứng thế vào nhân thơm của phenol. ⇒ Sai. Phản ứng thế vào benzen khó hơn.
(4) Phenol tan tốt trong etanol. ⇒ Đúng.
(5) Phenol làm quí tím hóa đỏ. ⇒ Sai. Phenol không làm đổi màu quỳ tím.
(6) Phenol phản ứng được với Brom ở điều kiện thường. ⇒ Đúng.
Bài 2:
Cho m gam hỗn hợp A gồm phenol (C6H5OH) và axit axetic tác dụng vừa đủ với p gam dung dịch nước brom C%, sau phản ứng thu được dung dịch B và 33,1 gam kết tủa trắng. Để trung hòa hoàn toàn B cần 144,144 ml dung dịch NaOH 10% (d = 1,11 g/ml). Giá trị của m là?
Hướng dẫn:
C6H5OH + 3Br2 → C6H2OH(Br)3 + 3HBr
⇒ nkết tủa = nphenol = 0,1 mol
nNaOH=nHBr+nCH3COOH⇒nCH3COOH=0,1 mol
⇒ m = 15,4g
Bài 3:
Cho m gam hỗn hợp gồm phenol (C6H5OH) và rezoxinol (1,3-đihiđroxibenzen) tác dụng vừa đủ với 400 ml dung dịch brom 1,5M (lượng tối đa) thu được 67,48 gam kết tủa. Giá trị của m là?
Hướng dẫn:
C6H5OH + 3Br2 → HOC6H2Br3 + 3HBr
x → 3x → x
C6H4(OH)2 + 3Br2 → (HO)2C6HBr3 +3HBr
y → 3y y
⇒ nBr2 = 3x + 3y = 0,6 mol
mkết tủa = 331x + 347y = 67,48g
⇒ x = 0,12; y = 0,08 mol
⇒ m = 20,08g
THAM KHẢO THÊM:




