Công thức hóa học KOH là công thức thí nghiệm phổ biến trong chương trinh hóa học. Bài viết dưới đây sẽ làm rõ công thức và kết quả của phương trinh hóa học KOH + H3PO4 → K3PO4 + H2O.
Mục lục bài viết
1. Khái niệm KOH là gì?
1.1. KOH là gì ?
KOH là viết tắt của cụm từ Potassium Hydroxide – một chất có tính kiềm mạnh, được sử dụng rộng rãi trong đời sống hàng ngày. Hợp chất có tính ăn mòn cao, được ứng dụng rộng rãi trong nhiều lĩnh vực. Đặc biệt là trong ngành phân bón và hóa chất. Là thành phần không thể thiếu trong hầu hết các loại mỹ phẩm đang được sử dụng hiện nay với tác dụng chính là giúp cân bằng độ PH.
1.2. Hóa chất KOH là gì?
Trong mỹ phẩm và các sản phẩm chăm sóc cá nhân, chúng ta thường bắt gặp một chất có tên là Kali Hydroxide. Viết tắt là KOH. Đây là một thành phần cực mạnh, chỉ với một lượng nhỏ, có thể tạo và duy trì độ pH của sản phẩm.
Kali Hydroxide là một hợp chất vô cơ. Hợp chất này có thể được tìm thấy ở dạng nguyên chất do phản ứng của Natri Hydroxide với Kali không tinh khiết. Kali hHydroxit thường được sử dụng thay thế cho Natri Hydroxide trong nhiều ứng dụng. Tuy nhiên, Natri Hydroxide được ưa chuộng hơn vì giá thành thấp hơn.
Kali Hydroxide là một chất kích thích mạnh. Nó tồn tại ở dạng bột kết tinh màu trắng, mùi đặc trưng, hút ẩm, tan hoàn toàn trong nước. Khi tan trong nước tỏa nhiều nhiệt.
Kali Hiđroxit được ứng dụng rộng rãi trong đời sống hàng ngày như sản xuất phân bón chứa kali, nguyên liệu chính trong sản xuất dầu diesel sinh học, dung dịch làm quần áo, vải len; Đặc biệt, nó được dùng trong ngành mỹ phẩm và dược phẩm với công dụng chính là tạo ra các carbomer nặng và độ pH trung tính.
1.3. Đặc trưng tính chất của KOH là gì?
a.Tính chất vật lý:
Kali Hydroxit là một bazơ mạnh, dễ dàng phản ứng với nước và carbon dioxide trong không khí để tạo thành Kali Cacbonat. Ở dạng dung dịch ăn mòn thủy tinh, vải, giấy, da… Ở thể rắn nóng chảy ăn mòn sứ, bạch kim… Dưới đây là một số tính chất vật lý tiêu biểu:
– Trạng thái vật lý: Chất rắn.
– Màu sắc: Màu trắng.
– Mùi: Không mùi.
– Nhiệt độ sôi: 1.327oC (1.6000 K; 2.421oF).
– Nhiệt độ nóng chảy: 406oC (679 K; 763oF).
– Độ hòa tan trong nước: 97 g/ml (0oC), 121 g/ml (25oC), 178 g/ml (100oC).
– Khả năng hòa tan chất khác: Hòa tan trong alcohol, glycerol. Không tan trong ether, amoniac lỏng.
– Khối lượng riêng: 2.044 g/cm3
– Độ pH: 13.
b.Tính chất hóa học:
Kali Hydroxit là một bazơ mạnh phản ứng nhanh với nước và carbon dioxide trong không khí để tạo thành Kali Cacbonat. Ở dạng dung dịch ăn mòn thủy tinh, vải, giấy, da… Ở dạng rắn nóng chảy ăn mòn sứ, bạch kim… Sau đây là một số tính chất vật lý tiêu biểu:
Ở điều kiện nhiệt độ phòng, KOH tác dụng với oxit axit như SO2, CO2:
KOH + SO2 → K2SO3 + H2O
KOH + SO2 → KHSO3
Tác dụng với axit tạo thành muối và nước:
KOH(dd) + HCl(dd) → KCl(dd) + H2O
Tác dụng với các axit hữu cơ để tạo thành muối và thủy phân este, peptit:
RCOOR1 + KOH → RCOOK + R1OH
Tác dụng với kim loại mạnh tạo thành bazo mới và kim loại mới:
KOH + Na → NaOH + K
Tác dụng với muối để tạo thành muối mới và axit mới:
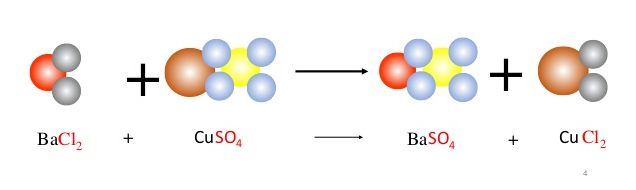
2KOH + CuCl2 → 2KCl + Cu(OH)2↓
KOH là một bazo mạnh, trong nước phân ly hoàn toàn thành ion Na+ và OH–
Phản ứng với một số oxit kim loại mà oxit, hidroxit của chúng lưỡng tính như nhôm, kẽm,…
2KOH + 2Al + 2H2O → 2KAlO2 + 3H2↑
2KOH + Zn → K2ZnO2 + H2↑
Phản ứng với một số hợp chất lưỡng tính:
KOH + Al(OH)3 → KAlO2 + 2H2O
2KOH + Al2O3 → 2KAlO2 + H2O
2. Phương trình phản ứng hóa học KOH tác dụng H3PO4:
Trong phản ứng hóa học này, Kali hidroxit (KOH) và axit photphoric (H3PO4) tương tác với nhau để tạo ra kali photphat (K3PO4) và nước (H2O).
– Điều kiện phản ứng:
Phản ứng này xảy ra khi có sự pha trộn giữa dung dịch kali hidroxit (KOH) và axit photphoric (H3PO4) trong điều kiện thích hợp.
– Đặc điểm phản ứng:
Phản ứng giữa KOH và H3PO4 là một phản ứng trung hòa axit – baz, trong đó KOH là baz mạnh, còn H3PO4 là axit yếu. Quá trình phản ứng sẽ tạo ra muối K3PO4 và nước (H2O). Công thức phản ứng là:
2KOH + H3PO4 → K3PO4 + 2H2O
Đặc điểm của phản ứng này là sinh ra nhiệt, có thể gây ra nguy hiểm nếu không thực hiện đúng cách. Ngoài ra, phản ứng này có thể tạo ra các sản phẩm phụ như KH2PO4 và H2, tuy nhiên sản phẩm chính vẫn là K3PO4 và H2O.
– Hướng dẫn phản ứng:
- Chuẩn bị dung dịch KOH và dung dịch H3PO4 với tỉ lệ phù hợp.
- Cho từ từ dung dịch H3PO4 vào dung dịch KOH và khuấy đều.
- Quan sát sự xuất hiện của kết tủa K3PO4 và đợi phản ứng kết thúc.
- Lọc bỏ kết tủa và thu được dung dịch K3PO4 và H2O.
– Cách thức phản ứng:
Trong phản ứng này, Kali hidroxit (KOH) được pha loãng trong nước để tạo ra một dung dịch và axit photphoric (H3PO4) cũng được pha loãng trong một dung dịch riêng. Dung dịch của hai chất này được trộn lẫn với nhau dưới sự khuấy đều để xảy ra phản ứng.
3. Axit phophoric tác dụng với kiềm:
Khi dung dịch kiềm tác dụng với axit H3PO4 các phản ứng có thể xảy ra
OH– + H3PO4 → H2PO4– + H2O
2OH– + H3PO4 → HPO42- + 2H2O
3OH + H3PO4 → PO43- + 3H2O
nOH–/nH3PO4 = T
T ≤ 1 ⇒ H2PO4–
T = 2 ⇒ HPO42-
1 < T < 2 ⇒ 2 muối: H2PO4– và HPO42-
2 < T < 3 ⇒ 2 muối: HPO42- và PO43-
T ≥ 3 ⇒ PO43-
4. Ứng dụng của phản ứng KOH + H3PO4:
Phản ứng hóa học giữa KOH và H3PO4 được sử dụng rộng rãi trong nhiều lĩnh vực khác nhau.
– Trong ngành công nghiệp
Phản ứng này được sử dụng để sản xuất các sản phẩm hóa học như phân bón và chất tẩy rửa. K3PO4, sản phẩm của phản ứng, là thành phần quan trọng của phân tích, đóng vai trò cung cấp lân cho cây trồng. Trong chất tẩy rửa, K3PO4 được dùng làm chất chống ăn mòn, bảo vệ bề mặt kim loại.
– Trong quá trình xử lý nước
Phản ứng KOH + H3PO4 còn được ứng dụng trong quá trình xử lý nước để tạo ra nguồn nước sạch và an toàn khi sử dụng. H3PO4 được sử dụng làm chất xúc tác để giảm độ ẩm của nước, trong khi KOH được sử dụng để tăng độ pH của nước. Kết quả của phản ứng này là sản phẩm K3PO4 và nước tinh khiết.
Ngoài ra, phản ứng KOH + H3PO4 được sử dụng trong nhiều ứng dụng khác nhau như trong sản xuất chất tẩy rửa, chất tẩy da chết, thuốc và trong sản xuất cao su tổng hợp.
Vận dụng kiến thức hoá học đã học để giải bài tập là một khâu quan trọng của quá trình học tập. Dưới đây là một số ví dụ bài tập và đáp án liên quan đến chất điện li
5. Bài tập vận dụng liên quan:
Câu 1:
Cho các chất sau: H3PO4, HF, C2H5OH, HClO2, Ba(OH)2, HClO3, CH3COOH, BaSO4, FeCl3, Na2CO3, HI. Trong số các chất trên, số chất điện li mạnh là
=> D (số chất điện li mạnh là 5)
Các chất điện li mạnh trong danh sách trên bao gồm: Ba(OH)2, HClO3, BaSO4, FeCl3, Na2CO3, HI. Lưu ý rằng các kết tủa như BaSO4 và BaCO3 có thể ít tan, nhưng các phân tử hòa tan phân ly hoàn toàn nên chúng vẫn được coi là chất điện ly mạnh.
Câu 2:
H3PO4 phân li ra mấy nấc?
Đáp án: B (H3PO4 phân li ra 2 nấc)
Câu 3:
Tìm chất tan trong dung dịch X khi cho H3PO4 tác dụng với dung dịch chứa KOH
Đề bài cho biết phản ứng giữa H3PO4 và dung dịch chứa KOH hoàn toàn. Ta giả sử m = 20 gam KOH có trong dung dịch, từ đó tính được số mol của KOH:
nKOH = m/M(KOH) = 0,5 mol
Sau phản ứng, thu được dung dịch X có chứa 1,22m gam chất tan. Theo đó:
mChất rắn = 1,22m = 24,4 gam
Giả sử OH- hết, ta suy ra:
H+ + OH- → H2O
nH+ phản ứng = 0
Để tính được số mol của H3PO4, ta sử dụng phương trình:
mH3PO4 + mNaOH = mH2O + mChất rắn
Từ đó, suy ra:
nH3PO4 = 0,1367 mol
Như vậy, trong dung dịch X có chứa NaH2PO4 và Na2HPO4.
Câu 4:
Xác định muối thu được khi cho (NH4)2SO4 tác dụng với dung dịch NaOH và H3PO4
Đầu tiên, ta tính số mol của (NH4)2SO4:
n(NH4)2SO4 = m/M((NH4)2SO4) = 0,02 mol
Đun nóng (NH4)2SO4 với dung dịch NaOH dư, ta thu được khí NH3:
(NH4)2SO4 + 2NaOH → 2NH3↑ + Na2SO4 + 2H2O
Ta tính số mol của H3PO4:
nH3PO4 = 0,08 mol
Do đó, phản ứng xảy ra giữa NH3 và H3PO4:
NH3 + H3PO4 → (NH4)2HPO4
6. Ví dụ minh họa:
Ví dụ 1: Khi cho KOH tác dụng với H3PO4 tỉ lệ số mol là 3:1. Muối thu được là:
A. K3PO4
B. K2HPO4
C. K2HPO4 và K3PO4
D. KH2PO4
Hướng dẫn giải
Đáp án đúng là: A
Phương trình hóa học:
3KOH + H3PO4 → K3PO4 + 3H2O
Ví dụ 2: Dung dịch KOH không có tính chất hoá học nào sau đây?
A. Làm quỳ tím hoá xanh.
B. Tác dụng với oxit axit tạo thành muối và nước.
C. Tác dụng với axit tạo thành muối và nước.
D. Bị nhiệt phân huỷ tạo ra oxit bazơ và nước.
Hướng dẫn lời giải
Đá án đúng là: D
KOH không bị nhiệt phân hủy.
Ví dụ 3: Để thu được muối trung hòa, cần bao nhiêu mL dung dịch KOH 1M tác dụng với 50 mL dung dịch H3PO4 0,5M.
A. 35mL.
B. 45mL.
C. 25 mL.
D. 75 mL.
Hướng dẫn lời giải
Đáp án đúng là: D
Tính theo PTHH: 3KOH + H3PO4 → K3PO4 + 3H2O
nH3PO4″> = 0,05.0,5 = 0,025 mol
3KOH + H3PO4 → K3PO4 + 3H2O
0,075 ← 0,025 mol
→ Vdd KOH = 0,0751″> = 0,075 lít = 75 mL.