Các hản ứng hóa học đóng vai trò quan trọng trong công nghiệp, nông nghiệp, và các lĩnh vực khác liên quan đến hóa học và phân tích. Dưới đây là bài viết về: "KOH + H2SO4 → K2SO4 + H2O" mời các bạn theo dõi.
Mục lục bài viết
1. KOH là gì?
KOH là công thức hóa học của kali hidroxit, một hợp chất hóa học có dạng chất rắn, kết tinh, có màu trắng và tan trong nước. Kali hidroxit được tạo thành từ kết hợp của một nguyên tử kali (K) và một nguyên tử hidroxit (OH-).
Kali hidroxit (KOH) là một hợp chất hóa học được biết đến là một bazơ mạnh có tính ăn mòn cao. Khi tiếp xúc với các chất acid, nó tạo thành muối và nước thông qua quá trình trao đổi ion. Kali hidroxit thường được sử dụng trong nhiều ứng dụng công nghiệp và có vai trò quan trọng trong các ngành như sản xuất xà phòng, thuốc nhuộm, thuốc nổ, phân bón và tổng hợp các hợp chất hóa học khác.
Trong lĩnh vực chăm sóc cá nhân, kali hidroxit được sử dụng rộng rãi trong việc sản xuất kem cạo râu, kem dưỡng da và các sản phẩm chăm sóc tóc. Với tính chất bazơ mạnh và khả năng điều chỉnh độ pH, kali hidroxit đóng vai trò quan trọng trong việc cân bằng pH của các sản phẩm này, giúp duy trì tính chất và hiệu quả của chúng.
Không chỉ có ứng dụng trong lĩnh vực chăm sóc cá nhân, kali hidroxit còn được sử dụng trong nhiều quá trình công nghiệp và hóa học. Với tính chất bazơ mạnh, nó có khả năng tác động lên các chất acid và tham gia vào các phản ứng trao đổi ion, trung hòa acid và điều chỉnh độ pH trong quá trình sản xuất và xử lý hóa chất. Đặc biệt, kali hidroxit được sử dụng rộng rãi trong ngành pin kiềm, nơi nó là một thành phần quan trọng để tạo ra điện áp và hiệu suất cao.
Ngoài các ứng dụng công nghiệp, kali hidroxit còn được sử dụng trong các quá trình phân tích hóa học và nghiên cứu khoa học. Đóng vai trò là một bazơ mạnh, nó có thể được sử dụng để điều chỉnh pH trong các phản ứng và thí nghiệm, giúp tạo điều kiện phản ứng phù hợp và đạt được kết quả chính xác.
Kali hidroxit cũng có tên gọi khác như kali hidroxua hoặc kali hydrate. Dưới dạng hạt hoặc viên, nó có màu trắng và có khả năng hút ẩm cao. Khi sử dụng kali hidroxit, cần thực hiện các biện pháp an toàn như đeo bảo hộ và hạn chế tiếp xúc trực tiếp với da và mắt, vì tính ăn mòn của nó có thể gây tổn thương.
2. H2SO4 là gì?
H2SO4 là công thức hóa học của axit sulfuric, một chất lỏng không màu, dẻo và có mùi hắc hơi mạnh. Axit sulfuric là một trong những axit quan trọng nhất và phổ biến nhất trong hóa học.
Axit sulfuric có công thức hóa học H2SO4, gồm hai nguyên tử hydro (H), một nguyên tử lưu huỳnh (S) và bốn nguyên tử oxi (O). Nó được tạo thành từ sự kết hợp của nguyên tử hydro (H+) và ion sulfat (SO4^2-). Axit sulfuric có tính chất đặc trưng là axit mạnh, có khả năng tác động mạnh lên các chất khác và có khả năng tạo thành muối khi tác động vào các bazơ.
Axit sulfuric là một chất điều chế quan trọng và được sử dụng rộng rãi trong nhiều lĩnh vực của công nghiệp hiện đại. Đây là một trong những axit mạnh và dung dịch của nó có tính ăn mòn cao, đặc trưng cho tính axit mạnh và khả năng tác động mạnh lên các chất và vật liệu khác.
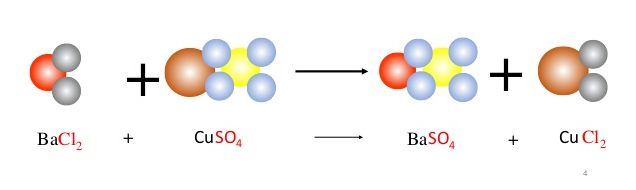
Một trong những ứng dụng chính của axit sulfuric là trong sản xuất phân bón. Axit sulfuric được sử dụng để sản xuất các loại phân bón giàu kali như muối kali sunfat (K2SO4) thông qua phản ứng trao đổi ion với kali hidroxit (KOH). Muối kali sunfat là một nguồn cung cấp kali và lưu huỳnh quan trọng trong việc cung cấp dinh dưỡng cho cây trồng, giúp tăng cường sự phát triển của cây và năng suất vụ mùa.
Axit sulfuric cũng được sử dụng trong công nghiệp thuốc nhuộm, nơi nó được sử dụng để điều chỉnh pH trong quá trình nhuộm màu. Ngoài ra, nó cũng có vai trò quan trọng trong sản xuất thuốc nổ, pin và chất tẩy rửa.
Trong các quá trình hóa học và phân tích, axit sulfuric được sử dụng để tạo điều kiện axit hoá, tách chất và tạo phản ứng hóa học khác. Với tính chất axit mạnh, nó có thể trung hòa các dung dịch bazơ và điều chỉnh độ pH trong các quá trình hóa học và phân tích. Ngoài ra, axit sulfuric còn có khả năng tác động lên các chất hữu cơ và không hữu cơ khác, tham gia vào các phản ứng oxi hóa và khử, và có thể được sử dụng để tách các chất phụ thuộc vào tính chất hóa học của chúng.
Thêm vào đó, axit sulfuric cũng có vai trò quan trọng trong các quá trình sản xuất và xử lý trong ngành công nghiệp. Ví dụ, nó được sử dụng trong quá trình tạo ra pin axit chì, làm sạch kim loại và bề mặt, xử lý nước thải và nhiều ứng dụng khác.
3. Phương trình cân bằng của KOH + H2SO4 → K2SO4 + H2O:
Phản ứng hóa học giữa kali hidroxit (KOH) và axit sulfuric (H2SO4) là một phản ứng trao đổi ion. Kết quả của phản ứng là kali sulfat (K2SO4) và nước (H2O).
Công thức hoá học của phản ứng này là:
KOH + H2SO4 → K2SO4 + H2O
=> 2KOH + H2SO4 → K2SO4 + 2H2O
Trong phản ứng này, hai phân tử kali hidroxit phản ứng với một phân tử axit sulfuric để tạo ra một phân tử kali sulfat và hai phân tử nước.
Phản ứng trên diễn ra do sự trao đổi ion giữa các ion trong các chất tham gia. Trong kali hidroxit, ion K+ và OH- tách ra. Trong axit sulfuric, phân tử H2SO4 tách thành hai ion H+ và SO4^2-. Trong quá trình phản ứng, ion K+ từ kali hidroxit kết hợp với ion SO4^2- từ axit sulfuric để tạo thành kali sulfat (K2SO4). Đồng thời, hai ion OH- từ kali hidroxit kết hợp với hai ion H+ từ axit sulfuric để tạo thành nước (H2O).
4. Ứng dụng của phương trình hóa học KOH + H2SO4 → K2SO4 + H2O:
Phản ứng giữa KOH và H2SO4 có nhiều ứng dụng trong công nghiệp.
– Sản xuất muối kali sunfat (K2SO4): Phản ứng trao đổi ion này được sử dụng để sản xuất muối kali sunfat, K2SO4. Muối này là một nguồn quan trọng của kali (K) và lưu huỳnh (S) trong công nghiệp và nông nghiệp. K2SO4 được sử dụng như một phân bón kali trong việc cung cấp dinh dưỡng cho cây trồng, giúp tăng cường sự phát triển của cây và năng suất của vụ mùa.
– Điều chỉnh độ pH: Phản ứng giữa kali hidroxit (KOH) và axit sulfuric (H2SO4) tạo ra nước (H2O) và có khả năng điều chỉnh độ pH của một hệ thống. Với tính chất bazơ mạnh của KOH và tính chất axit mạnh của H2SO4, phản ứng này có thể được sử dụng để tăng độ pH của một dung dịch axit hoặc giảm độ pH của một dung dịch bazơ.
– Trung hòa axit: Phản ứng trao đổi ion giữa KOH và H2SO4 có thể được sử dụng để trung hòa axit trong các ứng dụng công nghiệp và thí nghiệm. Khi có một dung dịch axit, việc thêm KOH vào dung dịch sẽ tạo ra muối kali và nước, giúp làm giảm tính chất axit của dung dịch và trung hòa nồng độ axit.
– Phân tích hóa học: Phản ứng trao đổi ion “KOH + H2SO4 → K2SO4 + H2O” có thể được sử dụng trong các phương pháp phân tích hóa học. Trong quá trình này, phản ứng này có thể được sử dụng để xác định nồng độ các ion có mặt trong một mẫu hoặc để phân tách các chất trong một hỗn hợp. Sự tạo thành muối và nước trong phản ứng này cung cấp thông tin về thành phần hóa học của mẫu và có thể được sử dụng để tính toán nồng độ các ion có mặt.
Các ứng dụng này đóng vai trò quan trọng trong công nghiệp, nông nghiệp, và các lĩnh vực khác liên quan đến hóa học và phân tích.
5. Phương trình trao đổi ion là gì?
Từ phương trình KOH + H2SO4 → K2SO4 + H2O hãy cùng tìm hiểu về phương trình trao đổi. Phương trình trao đổi ion là một phương trình hóa học mô tả phản ứng giữa các ion trong các chất tham gia phản ứng. Trong phản ứng này, các ion trong chất tham gia trao đổi vị trí với nhau để tạo thành các chất mới.
Phương trình trao đổi ion thường được biểu diễn dưới dạng phương trình hóa học, trong đó các ion được viết bằng các ký hiệu ion hoặc công thức hóa học. Các ký hiệu ion được viết theo quy tắc của hóa học vô cơ, với điện tích của ion được chỉ rõ bằng chỉ số trên và dưới ký hiệu ion.
Ví dụ, phản ứng giữa axit clohidric (HCl) và kali hydroxit (KOH) có thể được biểu diễn bằng phương trình trao đổi ion như sau:
H+ + Cl- + K+ + OH- → K+ + Cl- + H2O
Trong phản ứng trên, ion H+ từ axit clohidric trao đổi vị trí với ion OH- từ kali hydroxit, tạo thành nước (H2O). Đồng thời, ion K+ từ kali hydroxit trao đổi vị trí với ion Cl- từ axit clohidric, tạo thành muối kali clo (KCl). Quá trình trao đổi ion này là do sự tương tác và hấp thụ giữa các ion trên mặt phản ứng.
Phương trình trao đổi ion thể hiện quá trình trao đổi ion trong phản ứng hóa học và có thể diễn ra trong dung dịch hoặc trong các chất rắn. Phương trình này giúp chúng ta hiểu rõ hơn về cơ chế và quá trình diễn ra trong phản ứng trao đổi ion.