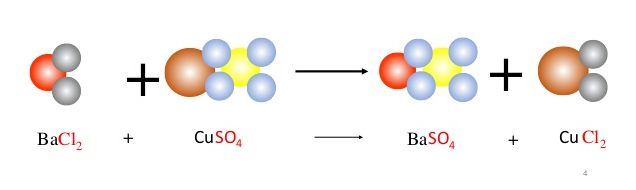
Phản ứng giữa K2CO3 (kali cacbonat) và HCl (axit clohidric) là một phản ứng trao đổi, trong đó các chất tham gia phản ứng tương tác với nhau để tạo ra các sản phẩm mới. Khi hai chất này phản ứng với nhau, chúng sẽ tạo ra KCl (muối kẽm), CO2 (khí cacbonic) và H2O (nước).
Mục lục bài viết
1. Tính chất của phản ứng K2CO3 + HCl → KCl + CO2 + H2O:
Phản ứng giữa K2CO3 (kali cacbonat) và HCl (axit clohidric) là một phản ứng trao đổi, trong đó các chất tham gia phản ứng tương tác với nhau để tạo ra các sản phẩm mới. Khi hai chất này phản ứng với nhau, chúng sẽ tạo ra KCl (muối kẽm), CO2 (khí cacbonic) và H2O (nước).
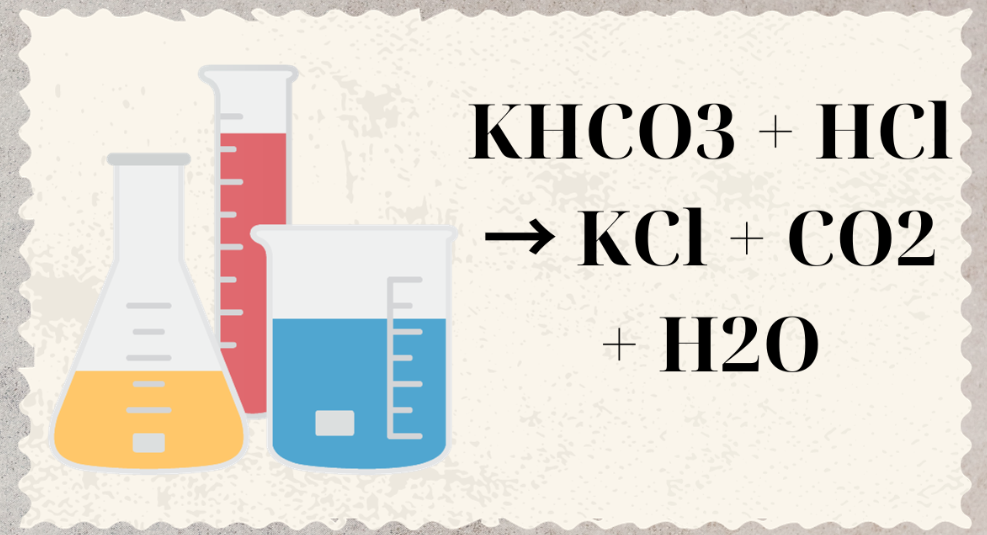
Công thức hóa học của phản ứng là: K2CO3 + 2HCl → 2KCl + CO2 + H2O
Ở đây, K2CO3 là kali cacbonat và HCl là axit clohidric. Khi hai chất này phản ứng với nhau, ion K+ trong K2CO3 sẽ trao đổi với ion H+ trong HCl, tạo ra KCl và nước. Trong khi đó, ion CO32- trong K2CO3 sẽ tách ra khỏi phân tử và kết hợp với ion H+ để tạo ra khí CO2.
Phản ứng này là một phản ứng khí đẳng hướng, nghĩa là sản phẩm khí CO2 sẽ bay ra khỏi dung dịch phản ứng. Điều này có thể được quan sát thấy bằng cách sử dụng ống nghiệm và cốc, và đặt ống nghiệm vào cốc chứa dung dịch phản ứng. Khi phản ứng diễn ra, khí CO2 sẽ bắn ra khỏi ống nghiệm và tạo thành bọt khí trên mặt dung dịch.
Trên thực tế, phản ứng này được sử dụng để tạo ra CO2 trong quá trình sản xuất bia và đồ uống có ga. Ngoài ra, nó còn được sử dụng trong sản xuất thuốc, phân bón và các sản phẩm hóa chất khác.
Một trong những tính chất đặc biệt của phản ứng này là tính chất khí đẳng hướng. Điều này có nghĩa là sản phẩm khí CO2 sẽ bay ra khỏi dung dịch phản ứng, và có thể được quan sát thấy bằng cách sử dụng các công cụ như ống nghiệm và cốc. Khi phản ứng diễn ra, khí CO2 sẽ bắn ra khỏi ống nghiệm và tạo thành bọt khí trên mặt dung dịch. Điều này làm cho phản ứng này trở nên rất đặc biệt và thú vị.
Ngoài tính chất khí đẳng hướng, phản ứng K2CO3 + HCl còn có nhiều ứng dụng khác trong cuộc sống. Trong sản xuất bia và đồ uống có ga, phản ứng này được sử dụng để tạo ra CO2, giúp tạo ra hương vị và tạo độ tươi mát cho sản phẩm. Nó còn được sử dụng trong sản xuất thuốc, phân bón và các sản phẩm hóa chất khác. Tuy nhiên, cần lưu ý rằng phản ứng này là một phản ứng rất mạnh, và cần được thực hiện cẩn thận để tránh các tai nạn không đáng có.
Vì vậy, phản ứng K2CO3 + HCl là một phản ứng trao đổi tạo ra các sản phẩm mới như KCl, CO2 và H2O. Phản ứng này có tính chất khí đẳng hướng và có nhiều ứng dụng trong cuộc sống. Tuy nhiên, cần lưu ý rằng phản ứng này là một phản ứng rất mạnh, và cần được thực hiện cẩn thận để tránh các tai nạn không đáng có.
2. Điều kiện xảy ra phản ứng K2CO3 + 2HCl → 2KCl + CO2 + H2O:
Phản ứng giữa K2CO3 và HCl được sử dụng trong nhiều ứng dụng khác nhau, từ sản xuất khí CO2 cho tới tẩy rửa bề mặt kim loại. Tuy nhiên, để phản ứng này xảy ra, cần phải đáp ứng đầy đủ các điều kiện cần thiết.
Đầu tiên, K2CO3 phải ở dạng rắn hoặc hòa tan trong nước để tạo điều kiện cho phản ứng xảy ra. Nếu không đủ ở dạng rắn hoặc hòa tan, phản ứng sẽ không thể xảy ra. Vì vậy, cần phải đảm bảo rằng K2CO3 đã được chuẩn bị đúng cách để đạt được kết quả tốt nhất.
Thứ hai, HCl phải ở dạng lỏng hoặc khí để phản ứng diễn ra. Nếu HCl ở dạng rắn, phản ứng sẽ không xảy ra. Vì vậy, cần phải đảm bảo rằng HCl đang ở dạng lỏng hoặc khí để đạt được hiệu quả tốt nhất.
Ngoài ra, phản ứng xảy ra ở nhiệt độ phòng. Nhiệt độ quá thấp có thể làm giảm tốc độ phản ứng, trong khi nhiệt độ quá cao có thể làm phản ứng quá nhanh, dẫn đến mất kiểm soát. Điều kiện áp suất không quá cao cũng cần được đảm bảo để tránh những tác động không mong muốn đến phản ứng.
Khi các điều kiện trên đều được đáp ứng, K2CO3 và HCl sẽ phản ứng với nhau, tạo ra KCl, CO2 và H2O. Tuy nhiên, nếu một trong các điều kiện không được đáp ứng, phản ứng có thể không xảy ra hoặc sẽ xảy ra không đúng cách, dẫn đến kết quả không mong muốn.
Chẳng hạn, nếu K2CO3 không được chuẩn bị đúng cách, có thể dẫn đến tạo ra sản phẩm phụ không mong muốn, gây độc hại hoặc làm giảm hiệu quả phản ứng. Hoặc nếu nhiệt độ không đủ để kích thích phản ứng, phản ứng có thể diễn ra quá chậm, làm giảm hiệu quả phản ứng hoặc khiến phản ứng không xảy ra.
Vì vậy, khi thực hiện phản ứng giữa K2CO3 và HCl, cần phải đảm bảo đầy đủ các điều kiện trên để đạt được hiệu quả tốt nhất. Nếu không đáp ứng được các điều kiện cần thiết, có thể dẫn đến sự lãng phí thời gian, năng lượng và nguy hiểm cho sức khỏe và môi trường.
3. Ứng dụng của phản ứng K2CO3 + 2HCl → 2KCl + CO2 + H2O:
Phản ứng K2CO3 + 2HCl là một phản ứng trung hòa giữa muối kali cacbonat và axit clohidric. Đây là một phản ứng hóa học cơ bản và được sử dụng rộng rãi trong nhiều lĩnh vực khác nhau.
Trong phản ứng này, muối kali cacbonat và axit clohidric phản ứng với nhau để tạo ra muối kali clorua, khí cacbon đioxit và nước. Sản phẩm cuối cùng có nhiều ứng dụng quan trọng trong cuộc sống hàng ngày và cả trong công nghiệp.
Dưới đây là một số ứng dụng của phản ứng K2CO3 + 2HCl:
3.1. Sản xuất khí CO2:
Phản ứng K2CO3 + 2HCl tạo ra khí CO2, một khí quan trọng trong nhiều quá trình công nghiệp và sản xuất ngành thực phẩm. Trong sản xuất bia, rượu và đồ uống có ga, khí CO2 được sử dụng để tạo bọt và độ tươi mát cho sản phẩm. Ngoài ra, khí CO2 còn được sử dụng để bảo quản thực phẩm, giúp giữ cho thực phẩm tươi lâu hơn.
3.2. Tẩy trắng giấy:
KCl có tính chất tẩy trắng và được sử dụng trong sản xuất giấy và bột giấy. Nó được sử dụng như một chất tẩy trắng tự nhiên và là một phần của quá trình sản xuất giấy.
3.3. Sản xuất muối kali:
KCl được sản xuất từ phản ứng K2CO3 + 2HCl, và được sử dụng trong sản xuất phân bón và các sản phẩm hóa học khác. Muối kali cũng được sử dụng như một chất bổ sung cho thức ăn gia súc và gia cầm.
3.4. Điều chỉnh độ pH:
K2CO3 có tính chất kiềm và có thể được sử dụng để điều chỉnh độ pH của các dung dịch. Nó được sử dụng rộng rãi trong công nghiệp và trong các ứng dụng y tế. Ví dụ, nó có thể được sử dụng để điều chỉnh độ pH của nước uống để giúp tăng cường sức khỏe và phòng chống bệnh.
3.5. Sản xuất xà phòng:
K2CO3 được sử dụng trong sản xuất xà phòng và các sản phẩm làm sạch khác. Nó được sử dụng như một chất tẩy rửa và là một thành phần quan trọng của nhiều sản phẩm làm sạch.
3.6. Sử dụng trong quá trình sản xuất dược phẩm:
Phản ứng K2CO3 + 2HCl còn được sử dụng trong quá trình sản xuất dược phẩm. Điều này có thể là do tính chất kiềm của K2CO3 và khả năng điều chỉnh độ pH của phản ứng.
3.7. Sử dụng trong sản xuất thuốc trừ sâu:
K2CO3 cũng được sử dụng trong sản xuất thuốc trừ sâu. Nó có khả năng tiêu diệt các loài sâu bọ khác nhau và được sử dụng trong các sản phẩm chăm sóc cây trồng.
3.8. Sử dụng trong sản xuất hóa chất:
Phản ứng K2CO3 + 2HCl được sử dụng để sản xuất các hóa chất quan trọng, bao gồm các chất chống oxy hóa, chất tẩy rửa, chất tẩy trắng và chất ức chế sự hình thành cặn. Nó cũng được sử dụng để sản xuất các chất phụ gia và chất bảo quản trong thực phẩm.
4. Bài tập trắc nghiệm liên quan:
Câu 1. Khi cho từ từ dung dịch K2CO3vào dung dịch H2SO4 khuấy đều, hiện tượng xảy ra là
A. xuất hiện chất khí bay ra ngay khi cho K2CO3 vào.
B. sau 1 thời gian thấy xuất hiện chất khí bay ra, dung dịch trong suốt.
C. không có khí thoát ra.
D. có khí thoát ra và xuất hiện kết tủa.
Câu 2. Tính chất nào nêu dưới đây là sai khi nói về 2 muối KHCO3 và K2CO3?
A. Cả 2 đều dễ bị nhiệt phân
B. Cả 2 đều tác dụng với axit mạnh giải phóng khí CO2
C. Cả 2 đều bị thủy phân tạo môi trường kiềm
D. Chỉ có muối NaHCO3 tác dụng với dung dịch NaOH
Câu 3. Khi cho kim loại K vào dung dịch CuSO4 thì sẽ xảy ra hiện tượng nào sau đây?
A. Ban đầu có xuất hiện kết tủa xanh, sau đó kết tủa tan ra, dung dịch trong suốt.
B. Ban đầu có sủi bọt khí, sau đó xuất hiện kết tủa xanh.
C. Ban đầu có sủi bọt khí, sau đó có tạo kết tủa xanh, rồi kết tủa tan ra, dung dịch trong suốt.
D. Chỉ có sủi bọt khí.
Câu 4. Dung dịch K2CO3 không phản ứng được với dung dịch
A. HCl
B. Ba(OH)2
C. BaCl2
D. NaHCO3