HCOOH + AgNO3 + H2O + NH3 → (NH4)2CO3+ Ag + NH4NO3 là phản ứng tráng gương của Axit fomic. Quý độc giả cùng tham khảo bài viết dưới đây để nắm rõ hơn.
Mục lục bài viết
1. Phương trình Axit fomic tác dụng với AgNO3:
2 AgNO3 + H2O + 4NH3 + HCOOH → (NH4)2CO3 + 2 Ag ↓ + 2 NH4NO3
– Điều kiện phản ứng HCOOH tác dụng với dung dịch AgNO3/NH3 là:
Điều kiện để xảy ra phản ứng trên: Không có
– Cách để tiến hành phản ứng cho HCOOH tác dụng với dung dịch AgNO3/NH3 là:
Chúng ta Cho axit formic HCOOH tác dụng với AgNO3 trong dung dịch NH3
– Hiện tượng Hóa học khi cho HCOOH tác dụng với dung dịch AgNO3/NH3 là:
Khi Axit fomic HCOOH tác dụng với AgNO3 trong dung dịch NH3 tạo ra kết tủa trắng bạc, hay còn gọi là phản ứng tráng gương
2. Một vài điều cần biêt về AgNO3 và HCOOH:
2.1.Tim hiểu về HCOOH:
a. Khái niệm:
Axit formic, còn được gọi là axit formic hoặc axit formic (HCOOH), là một chất lỏng không màu, không mùi và là một axit yếu.
Công thức hóa học của axit fomic là: CH2O2 hoặc HCOOH.
b. Tính chất vật lý và tinh chất hóa học:
* Tính chất vật lý:
Tuy là axit yếu nhưng so trong dãy đồng đẳng của axit cacboxylic no, đơn chức, mạch hở, chúng là axit mạnh nhất, mạnh hơn cả axit cacbonic (H2CO3) vì ảnh hưởng đến mật độ electron trong nhóm. -COOH.
* Tính chất hóa học:
Dung dịch HCOOH làm quỳ tím hóa xanh.
Hoạt động với kim loại mạnh.
2Na + 2HCOOH → 2HCOONa + H2
– Phản ứng với oxit bazơ.
CuO + 2HCOOH → (HCOO)2Cu + H2O
– Phản ứng với bazơ.
NaOH + HCOOH → HCOONa + H2O
– Phản ứng với muối của axit yếu hơn.
NaHCO3 + HCOOH → HCOONa + CO2 + H2O
– Phản ứng este hóa.
HCOOH + CH3OH → HCOOCH3 + H2O.
(Đây là một phản ứng thuận nghịch được thúc đẩy bởi axit sulfuric và nhiệt độ cụ thể.)
– Phản quang.
HCOOH + 2[Ag(NH3)2]OH → (NH4)2CO3 + 2Ag↓ + 2NH3↑ + H2
c. Một vài ứng dụng quan trọng của HCOOH:
– Ứng dụng của axit formic trong ngành nhuộm
Axit formic được sử dụng trong Chất tạo màu và Chất sửa chữa như một chất gắn màu. Vì chúng là chất trung hòa và điều chỉnh pH trong nhiều công đoạn của quá trình Gia công hàng may mặc.
– Thuốc sát trùng, khử trùng
Chúng là chất khử trùng và chất diệt khuẩn có giá trị trong nhiều ứng dụng tẩy rửa công nghiệp hoặc cũng thường được sử dụng trong cuộc sống hàng ngày.
– Dung môi trung gian
Là một chất trung gian để sử dụng dung môi trong các chất độn còn được gọi là axit methanoic.
– Giúp điều chỉnh độ pH
Đây là trò chơi mà axit formic được sử dụng để điều chỉnh giá trị pH trong khử lưu huỳnh khí, đông tụ mủ và nhiều ứng dụng quan trọng khác.
– Các ứng dụng khác của axit formic
Bên cạnh đó, chúng còn được sử dụng để hỗ trợ tổng hợp hóa học và mạ điện, khai thác dầu khí, chất điều vị thực phẩm, v.v.
d. Khi sử dụng và bảo quản axit fomic cần chú ý điều gì?
Để sử dụng hiệu quả và bảo toàn quyền quản lý, bạn cần lưu lại những thứ sau:
Trong quá trình sử dụng axit formic tuyệt đối tránh để axit tiếp xúc trực tiếp với mắt hoặc tiếp xúc trực tiếp với da quá lâu sẽ ảnh hưởng rất lớn đến sức khỏe.
Nếu hít phải một lượng lớn, ảnh hưởng nghiêm trọng đến đường hô hấp, nên đưa nạn nhân đến nơi thoáng mát và đến gặp bác sĩ ngay.
Với nhiệt độ cao, chúng có thể rất nguy hiểm vì tính chất ăn mòn của nó.
Axit formic cũng có thể gây ra các triệu chứng nguy hiểm cho cơ thể như bỏng rát, buồn nôn, sần sùi, nổi mụn nước và khó chịu xung quanh vùng bị ảnh hưởng.
Axit formic nên được bảo quản ở nơi khô ráo, thoáng mát và tránh xa nguồn nhiệt và ngọn lửa.
2.2.Tìm hiểu về AgNO3:
a. Khái niệm:
AgNO3 là công thức hóa học của bạc nitrat. Đây là hợp chất phổ biến của bạc với axit nitric, có nhiều tên gọi khác nhau như bạc đơn sắc, muối axit nitric (I),…
Hóa chất này được biết đến là dạng tinh thể không màu, dễ hòa tan trong nước. Dung dịch AgNO3 chứa một lượng lớn các ion bạc, đó là lý do tại sao nó có tính oxi hóa và ăn mòn mạnh nhất.
Đây là loại hóa chất được sử dụng phổ biến hiện nay để mạ bạc, phản quang, trong ấn phẩm, trong y học, trong gió và mưa…
b. Những tính chất lí hóa của nitrat bạc:
* Tính chất vật lý của AgNO3:
Nó là một tinh thể dễ vỡ, trong suốt không màu.
Hòa tan trong nước và amoniac, ít tan trong etanol khan và hầu như không tan trong axit nitric đậm đặc.
Các dung dịch của nó có tính axit yếu, oxy hóa mạnh và ăn mòn nhất.
| KHỐI LƯỢNG RIÊNG | 5.35 g/cm3 |
| ĐIỂM NÓNG CHẢY | 212 °C (485 K; 414 °F) |
| ĐIỂM SÔI | 444 °C (717 K; 831 °F) |
| ĐỘ HÒA TAN TRONG NƯỚC | 1220 g/L (0 °C) 2160 g/L (20 °C) 4400 g/L (60 °C) 7330 g/L (100 °C) |
| ĐỘ HÒA TAN | hòa tan trong acetone, Amoniac, Ete, Glyxerol |
| CHIẾT SUẤT (ND) | 1.744 |
* Tính chất hóa học của AgNO3:
Sau đây là những tính chất hóa học nổi bật của bạc nitrat:
-Tham gia phản ứng oxi hóa khử:
N2H4 + 4AgNO3 → 4Ag + N2 + 4HNO3
H3PO3 + 2AgNO3 + H2O → 2Ag + H3PO4 + 2HNO3
2AgNO3 + Cu → Cu(NO3)2 + 2Ag
-Tham gia phản ứng phân hủy: AgNO3 → 2Ag + 2NO2 + O2
Có phản ứng với NH3:
2AgNO3 + 2NH3 · H2O → Ag2O + H2O + 2NH4NO3 (lượng nhỏ amoniac)
AgNO3 + 3NH3 · H2O → Ag(NH3)2OH + NH4NO3 + 2H2O (dư amoniac)
– Tham gia phản ứng với axit:
AgNO3 + HCl → AgCl + HNO3
HBr + AgNO3 → AgBr + HNO3
– Phản ứng với NaOH:
2NaOH + 2AgNO3 → 2NaNO3 + Ag2O + H2O
– Phản ứng với khí clo:
Cl2 + H2O → HCl + HClO HCl + AgNO3 → AgCl + HNO3
c. Điều chế AgNO3 Bạc Nitrat:
Dưới đây là một số cách giúp điều chế chế độ AgNO3:
3 Ag + 4 HNO3(lạnh và chiến lược) → 3 AgNO3 + 2 H2O + NO
3 Ag + 6 HNO3(đặc, nóng) → 3 AgNO3 + 3 H2O + 3 NO2
(Lưu ý: Quá trình này cần điều kiện có tủ hút vì các oxit độc hại sinh ra trong phản ứng cực kỳ nguy hiểm).
d. Những ứng dụng quan trọng của AgNO3 trong cuộc sống, sản xuất :
– Ứng dụng của AgNO3 trong quá trình hóa học
+ Bạc nitrat được sử dụng để kết hợp các ion clorua.
+ AgNO3 được dùng để hiệu chuẩn dung dịch natri clorua.
– Ứng dụng của AgNO3 trong công nghiệp
+ Dùng để sản xuất các loại bạc.
+ AgNO3 được sử dụng để tạo ra các chất liên kết dẫn điện, máy lọc không khí mới, quần áo cân bằng áp suất mạ bạc hoặc găng tay cho công việc trực tiếp.
+ Nó cũng là vật liệu nhạy sáng cho phim, phim x-quang và phim chụp ảnh.
+ Dùng để mạ bạc các linh kiện điện tử và hàng thủ công mỹ nghệ khác…
+ AgNO3 được sử dụng trong sản xuất pin bạc.
– Ứng dụng y học của AgNO3
+ AgNO3 có vai trò quan trọng trong y học, chúng giúp ăn mòn mô hạt, tăng sinh và phân giải dung dịch, dùng để pha chế chất diệt nấm trong máy sát trùng mắt.
– Các ứng dụng khác
+ Hóa chất này là một tác nhân để phát hiện aldehyde và đường.
+ Để đo ion clorua, chất xúc tác để xác định mangan, mạ điện, chụp ảnh và tạo màu sứ.
3. Bài tập vận dụng liên quan:
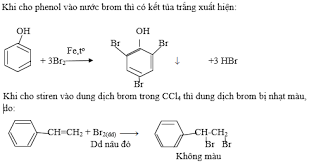
Câu 1: Cho các chất: etilen, axit metacrylic, styren, ancol benzylic, anilin, toluen, phenol (C6H5OH), CO2, SO2 sacarozơ, fructozơ. Số chất có khả năng làm mất màu nước brom là bao nhiêu:
A. 7
B. 5
C. 6
D. 4
ĐÁP ÁN C
Các chất làm mất màu dung dịch nước Br2 là: etilen (CH2=CH2); axit metacrylic (CH2=CH-COOH); anilin (C6H5NH2); styren (C6H5CH=CH2); phenol (C6H5OH), SO2
→ có 6 chất
Câu 2: Chất nào sau đây tham gia phản ứng tráng gương (tráng bạc):
A. HCOOC2H5
B. CH3-O-CH3
C. CH2=CH2
D. C2H5OH
Đáp án A
HCOOC2H5 có khả năng tham gia phản ứng tráng gương vì có cấu tạo tạo HCOOR dạng nhóm RO-CHO –CHO có khả năng tráng gương:
RO-CHO + 2AgNO3 + 3NH3 + H2O → ROCOONH4 + 2Ag↓ + 2NH4NO3.
Thì ta chọn đáp án A.
Câu 3: Cho dãy các chất dưới đây: propin, but – 2- in, axit fomic, axit axetic, anđehit axetic, anđehit acrylic, etyl fomat, metyl axetat. Số chất tác dụng với dung dịch AgNO3/NH3 tạo kết tủa là
A. 3
B. 6
C. 5
D. 4
ĐÁP ÁN C
Số chất tác dụng được với dung dịch AgNO3/NH3 tạo hỗn hợp là propin, axit fomic, anđehit axetic, anđehit acrylic, etyl fomat
Câu 4: Dùng hóa chất nào sau đây để phân biệt axit fomic và axit axetat?
A. CO2
B. Quỳ tím
C. NaOH
D. Dung dịch AgNO3/NH3
Đáp án D Vì HCOOH có nhóm -CHO còn axit axetic không có nhóm -CHO nên để phân biệt axit fomic (HCOOH) và axit axetic (CH3COOH) dùng thuốc thử là dung dịch AgNO3/NH3, dung dịch này cho HCOOH phản ứng với dung dịch nào. AgNO3/NH3, xuất hiện kết tủa Ag:
Phương trinh phản ứng là:
HCOOH + 2AgNO3+ 4NH3 + H2O (NH4)2CO3 +2Ag↓ + 2NH4NO3
Không xuất hiện CH3COOH có hiện tượng gì
Câu 5: Chất nào sau đây có thể làm khô khí NH3 có lẫn hơi nước?
A. P2O5.
B. H2SO4 đặc.
C. CuO bột.
D. NaOH rắn.
Đáp án D
Để có thể trả lời câu hỏi này, bạn đọc cần ghi nhớ quy tắc chung:
Chất hút ẩm là chất có khả năng hút ẩm mạnh.
Chất hút ẩm không hoạt động, không hòa tan trong khí (tất cả đều có mặt nước)
Trong quá trình làm khô không khí, không giải nén nếu không.