HCHO + AgNO3 + NH3 + H2O → Ag + NH4NO3 + (NH4)2CO3 là phản ứng tráng gương của anđehit fomic, được chúng minh biên soạn cụ thể trong bài viết dưới đây. Hy vọng qua tài liệu này có thể giúp các bạn viết và cân bằng phương trình một cách nhanh và chính xác hơn.
Mục lục bài viết
1. Phương trình phản ứng tráng gương của Anđehit Fomic:
HCHO + 4AgNO3 + 6NH3 + 2H2O → 4Ag + 4NH4NO3 + (NH4)2CO3
– Điều kiện phản ứng HCHO tác dụng với dung dịch AgNO3/NH3
Phản ứng xảy ra trong điều kiện: Không có
– Cách tiến hành phản ứng cho dung dịch HCHO tác dụng với dung dịch AgNO3/NH3
Đầu tiên, ta Cho HCHO tác dụng với dung dịch AgNO3/NH3.
– Hiện tượng nhận biết HCHO tác dụng với dung dịch AgNO3/NH3
Khi xảy ra phản ứng ta quan sát thấy hiện tượng Có kết tủa trắng Ag, có khí thoát ra chính là NH4NO3
2. Tìm hiểu về NH4NO3:
2.1. NH4NO3 là gì?
NH4NO3 là công thức hóa học của hợp chất muối trung tính có tên là amoni nitrat. Đây là một hợp chất hóa học mang tinh thể màu trắng, hút ẩm mạnh và tan trong nước.
NH4NO3 còn có các tên gọi khác nhau như Amoni nitrat, Amoni nitrat, Amoni nitrat, v.v.
NH4NO3 được sử dụng trực tiếp để chế tạo thuốc nổ và đặc biệt nó còn là hóa chất cơ bản trong sản xuất phân bón và một số lĩnh vực công nghiệp khác có sử dụng hóa chất.
2.2. Tính chất vật lý:
– Amoni nitrat là chất rắn, màu trắng, hút ẩm mạnh và hòa tan trong nước.
– Khối lượng mol của NH4NO3 là 0,04336 g/mol.
– Số CAS của NH4NO3 là 6484-52-2.
– Khối lượng riêng của NH4NO3 là 1,73 g/cm³, chất rắn.
– Điểm nóng chảy của NH4NO3 là 169 °C.
– Điểm sôi của NH4NO3 xấp xỉ. 210°C.
– Độ tan trong nước của NH4NO3 là:
119 g/100 ml (0 °C),
190 g/100 ml (20 °C)
286 g/100 ml (40 °C)
421 g/100 ml (60 °C)
630 g/100 ml (80 °C)
1024 g/100 ml (100 °C)
2.3. Tính chất hóa học của NH4NO3:
– Amoni nitrat có thể bị phân hủy nhiệt dưới tác dụng của nhiệt độ từ 190 – 245 độ C, làm xuất hiện bọt khí do Dinito Oxit (N2O) sinh ra:
NH4NO3 2H2O + N2O
– Amoni nitrat có thể phản ứng với các axit như HCl, H2SO4 theo phương trình sau:
HCl + NH4NO3 HNO3 + NH4Cl
H2SO4 + 2NH4NO3 (NH4)2SO4 + 2HNO3
Amoni nitrat có thể phản ứng với các bazơ như
KOH + NH4NO3 H2O + KNO3 + NH3
NaOH + NH4NO3 NaNO3 + NH4OH
Ca(OH)2 + 2NH4NO3 ⟶ Ca(NO3)2 + 2H2O + 2NH3.
Amoni nitrat có thể được kết hợp với muối như:
Na3PO4 + NH4NO3 + Be(NO3)2 ⟶ 3NaNO3 + Be(NH4PO4).
2.4. Ứng dụng:
-Làm nguyên liệu phân bón:
Amoni nitrat ở dạng phân bón sẽ bổ sung đạm cho cây trồng thông qua nitrat và amoni. Đây là loại phân bón rất dễ hấp thu giúp cây trồng đạt hiệu quả kinh tế cao, đồng thời thúc đẩy các thông số về sinh trưởng và năng suất.
Ngoài ra, amoni nitrat sẽ không làm chua đất và một số cây trồng cần bổ sung nitrat như bông, đay, mía, ngô, cà phê, cao su, cây ăn quả lâu năm. -Sản xuất thuốc nổ
Ammonium nitrate hiện là một chất được chính phủ quản lý vì nó dễ nổ và đang được sử dụng trong sản xuất chất nổ vì các đặc tính đặc biệt của nó như chất oxy hóa mạnh và độ hút ẩm cao nên rất dễ cháy.
-Các ứng dụng khác
Nitrat amoni cũng được sử dụng trong các sản phẩm túi khí ướp lạnh bao gồm hai lớp – một lớp chứa amoni nitrat khô và lớp kia chứa nước.
Amoni nitrat được sử dụng cho ngành may mặc, công nghiệp mạ điện, công nghiệp khai khoáng, công nghiệp hàn, v.v.
Amoni nitrat dùng cho công nghiệp hóa chất, tạo oxydol, amoni phản ứng.
2.5. Tại sao NH4NO3 lại dễ cháy nổ?
Khi một mình amoni nitrat không được coi là một chất nguy hiểm nhưng trong những điều kiện nhất định, nó có thể chuyển hóa thành chất nổ mà không cần bất kỳ chất xúc tác hay nhiên liệu bên ngoài nào.
Khi bị phân hủy amoni nitrat sẽ sinh nhiệt và có thể tự bốc cháy và duy trì ngọn lửa khi đủ nhiệt mà không cần đến các tác nhân như đánh lửa. Trong khi cháy, amoni nitrat sẽ trải qua các thay đổi hóa học dẫn đến việc tạo ra oxy giúp duy trì ngọn lửa, ngay cả khi chỉ số lan rộng. Khi nó nóng lên, amoni nitrat chảy ra từ phía sau tiếp tục nóng lên và tạo thành khí. Khí nóng nở ra nhưng bị đóng kín trong amoni nitrat nóng chảy và không được phép thoát ra ngoài sẽ buộc nó bị phân hủy về mặt hóa học và dẫn đến nổ.
3. Tìm hiểu về AgNO3:
3.1. AgNO3 là gì?
AgNO3 là công thức hóa học của bạc nitrat. Đây là hợp chất phổ biến của bạc với axit nitric, có nhiều tên gọi khác nhau như bạc đơn sắc, muối axit nitric (I),…
Hóa chất này được biết đến là dạng tinh thể không màu, dễ hòa tan trong nước. Dung dịch AgNO3 chứa một lượng lớn các ion bạc, đó là lý do tại sao nó có tính oxi hóa và ăn mòn mạnh nhất.
Đây là loại hóa chất được sử dụng phổ biến hiện nay để mạ bạc, phản quang, trong ấn phẩm, trong y học, trong nhuộm tóc…
3.2. Tính chất vật lý của AgNO3?
– Nó là một tinh thể dễ vỡ, trong suốt không màu.
– Hòa tan trong nước và amoniac, ít tan trong etanol khan và hầu như không tan trong axit nitric đậm đặc.
– Nó có tính axit yếu, oxy hóa mạnh và ăn mòn nhất.
| HỐI LƯỢNG RIÊNG | 5.35 g/cm3 |
| ĐIỂM NÓNG CHẢY | 212 °C (485 K; 414 °F) |
| ĐIỂM SÔI | 444 °C (717 K; 831 °F) |
| ĐỘ HÒA TAN TRONG NƯỚC | 1220 g/L (0 °C) 2160 g/L (20 °C) 4400 g/L (60 °C) 7330 g/L (100 °C) |
| ĐỘ HÒA TAN | hòa tan trong acetone, Amoniac, Ete, Glyxerol |
| CHIẾT SUẤT (ND) | 1.744 |
3.3. Tính chất hóa học của AgNO3 là gì?
Sau đây là những tính chất hóa học nổi bật của bạc nitrat:
Tham gia phản ứng oxi hóa khử:
N2H4 + 4AgNO3 → 4Ag + N2 + 4HNO3
H3PO3 + 2AgNO3 + H2O → 2Ag + H3PO4 + 2HNO3
2AgNO3 + Cu → Cu(NO3)2 + 2A
Tham gia phản ứng phân hủy:
AgNO3 → 2Ag + 2NO2 + O2
Có phản ứng với NH3:
2AgNO3 + 2NH3 · H2O → Ag2O + H2O + 2NH4NO3 (lượng nhỏ amoniac)
AgNO3 + 3NH3 · H2O → Ag(NH3)2OH + NH4NO3 + 2H2O (dư amoniac)
Tham gia phản ứng với axit:
AgNO3 + HCl → AgCl + HNO3
HBr + AgNO3 → AgBr + HNO3
Phản ứng với NaOH:
2NaOH + 2AgNO3 → 2NaNO3 + Ag2O + H2O
Phản ứng với khí clo:
Cl2 + H2O → HCl + HClO HCl + AgNO3 → AgCl + HNO3
3.4. Những ứng dụng quan trọng của AgNO3 trong cuộc sống, sản xuất:
a. Ứng dụng của AgNO3 trong hóa phân tích:
Bạc nitrat được sử dụng để kết hợp các ion clorua.
AgNO3 được dùng để hiệu chuẩn dung dịch natri clorua.
b. Ứng dụng của AgNO3 trong công nghiệp:
Dùng để sản xuất các loại bạc.
AgNO3 được sử dụng để tạo ra các chất liên kết dẫn điện, máy lọc không khí mới, quần áo cân bằng áp suất mạ bạc hoặc găng tay cho công việc trực tiếp.
Nó cũng là vật liệu nhạy sáng cho phim, phim x-quang và phim chụp ảnh.
Dùng để mạ bạc các linh kiện điện tử và hàng thủ công mỹ nghệ khác…
AgNO3 được sử dụng trong sản xuất pin bạc.
c. Ứng dụng y học của AgNO3:
AgNO3 có vai trò quan trọng trong y học, chúng giúp ăn mòn mô hạt, tăng sinh và phân giải dung dịch, dùng để pha chế chất diệt nấm trong máy sát trùng mắt.
d. Các ứng dụng khác:
Hóa chất này là một tác nhân để phát hiện aldehyde và đường.
Để đo ion clorua, chất xúc tác để xác định mangan, mạ điện, chụp ảnh và tạo màu sứ.
4. Bài tập vận dụng liên quan và hướng dẫn lời giải:
Câu 1. Hãy cho biết Có bao nhiêu anđehit 2 chức có công thức đơn giản là C2H3O?
A. 2
B. 4
C. 1
D. 3
Đáp án A
Giải thích:
Hướng dẫn Anđehit 2 chức có 2 nhóm –CHO => phân tử có 2 nguyên tử O
=> CTPT: C4H6O2
Có 2 công thức thỏa mãn là
OHC-CH2-CH2-CHO
CH3-CH(CHO)2
Câu 2. Hãy cho biết Dãy nào sau đây gồm các chất đều tác dụng được với dung dịch AgNO3/NH3
A. Anđehit fomic, but-1-in, axetilen
B. Axetilen, metan, etilen
C. Anđehit fomic, but – 1-en, axetilen
D. Butanol, phenol, but-1-in
Đáp án D
Giải thích:
Dãy gồm các chất đều tác dụng được với dung dịch AgNO3/NH3 là anđehit fomic, but-1-in, axetilen.
Các phương trình hóa học xảy ra
C2H2+ 2AgNO3+ 2NH3 → Ag2C2↓ + 2NH4NO3
HCHO + 4AgNO3+ 6NH3 + 2H2O → (NH4)2CO3 + 4Ag↓ + 4NH4NO3
C4H6 + AgNO3 + NH3→ C4H5Ag↓ + NH4NO3
Câu 3: Để trung hòa 6,72 gam một axit cacboxylic Y (no, đơn chức), cần dùng 200 gam dung dịch NaOH 2,24%. Công thức của Y là công thức nào sau đây:
A. CH3COOH.
B. HCOOH.
C. C2H5COOH.
D. C3H7COOH.
Đáp án A
Giải thích:
Hướng dẫn nNaOH = 0,112 mol
Y là axit no, mạch hở => nRCOOH = nNaOH = 0,112 mol
=> M = 6,72 / 0,112 = 60 => Y là CH3COOH
Câu 4. Hãy cho biết Chất nào dưới đây không thể điều chế trực tiếp từ CH3CHO:
A. C2H2.
B. CH3COOH.
C. C2H5OH.
D. CH3COOC2H3.
Đáp án A
Giải thích:
Phương trình phản ứng minh họa
CH3COOH + H2 → CH3CHO + H2O
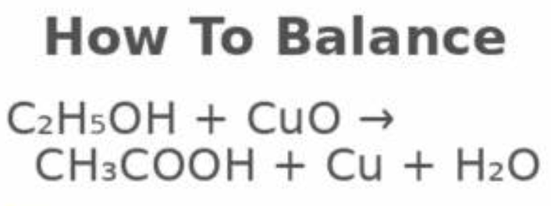
C2H5OH + CuO → CH3CHO + Cu + H2O
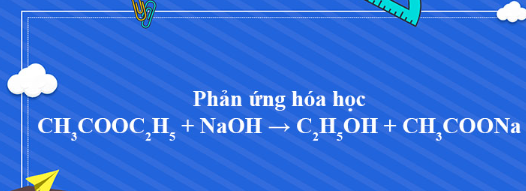
CH3COOC2H3+ NaOH → CH3COONa + CH3CHO + H2O
Câu 5. Cho Hai chất X và Y có cùng công thức phân tử C3H4O2. X tác dụng với CaCO3 tao ra CO2. Y tác dụng với dung dịch AgNO3/NH3 tạo Ag. Công thức cấu tạo thu gọn phù hợp của X, Y lần lượt là công thức nào sau đây:
A. CH2=CHCOOH, OHC-CH2-CHO.
B. CH3CH2COOH, HCOOCH2CH3.
C. HCOOCH=CH2, CH3COOCH3.
D. HCOOCH=CH2, CH3CH2COOH.
Đáp án A
Giải thích:
Phương trình phản ứng minh họa
2CH2=CHCOOH + CaCO3 →(CH2=CHCOO)2Ca + CO2 + H2O
OHC-CH2-CHO + 2Ag2O → HOOCCH2COOH + 4Ag