Mục lục bài viết
1. Tính chất phản ứng giữa H2S + H2SO4 → SO2 + H2O + S:
Phản ứng giữa H2S và H2SO4 là một phản ứng oxi-hóa khử quan trọng trong hóa học. Khi hai chất này phản ứng với nhau, electron được chuyển từ H2S đến H2SO4, tạo ra SO2 và S.
Công thức phản ứng hoá học:
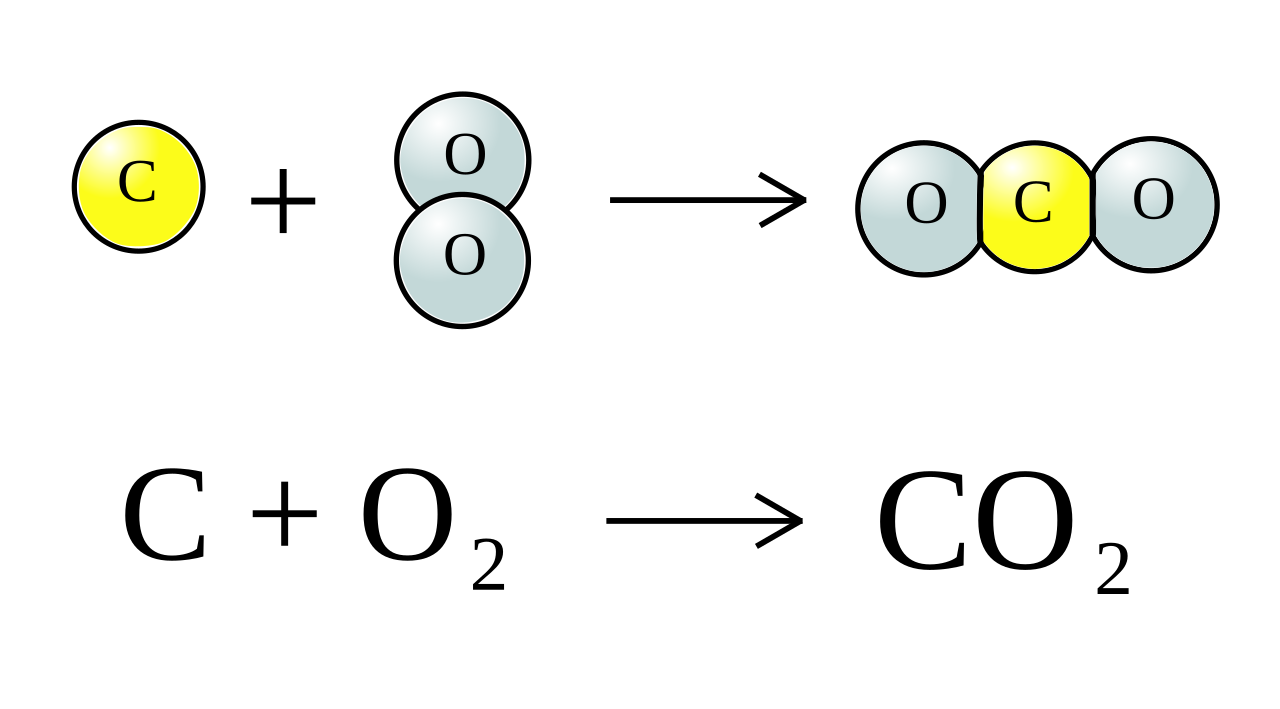
H2S + H2SO4 → SO2 + H2O + S
Trong phản ứng này, H2S hoạt động như một chất khử, còn H2SO4 hoạt động như một chất oxi hóa. Chất khử là chất nhận electron trong phản ứng oxi-hoá khử, trong khi chất oxi hóa lại cho electron. Trong phản ứng này, H2S trao đổi electron với H2SO4, tạo ra SO2 và S.
SO2 là một chất béo học quan trọng trong sản xuất axit sunfuric, được sử dụng để sản xuất phân bón, thuốc trừ sâu, chất tẩy rửa và trong quá trình sản xuất giấy. Ngoài ra, SO2 còn được sử dụng để làm nguyên liệu trong sản xuất hợp chất hữu cơ như sulfat, sulfonat và sulfoxide.
Một ứng dụng quan trọng khác của phản ứng giữa H2S và H2SO4 là trong sản xuất sulfur. Sau khi tạo ra SO2, nó có thể được chuyển đổi thành sulfur thông qua các phản ứng hóa học khác. Sulfur được sử dụng rộng rãi trong sản xuất các sản phẩm hóa học, trong sản xuất pin, trong sản xuất thuốc trừ sâu và trong sản xuất thực phẩm.
Ngoài ra, phản ứng giữa H2S và H2SO4 cũng được sử dụng trong phòng thí nghiệm để phân tích hoá học và trong sản xuất các hợp chất hữu cơ.
Phản ứng này còn có thể được sử dụng để giảm thiểu khí thải độc hại. SO2 được coi là một tác nhân gây ô nhiễm môi trường và có thể gây ra các vấn đề sức khỏe nghiêm trọng cho con người. Do đó, nhiều nhà máy điện và nhà máy sản xuất thép sử dụng phản ứng giữa H2S và H2SO4 để giảm thiểu khí thải SO2 bằng cách chuyển đổi nó thành sulfur.
Tóm lại, phản ứng giữa H2S và H2SO4 là một phản ứng oxi-hoá khử quan trọng trong hóa học, có nhiều ứng dụng trong sản xuất các chất hóa học, giảm thiểu khí thải độc hại và sản xuất sulfur. Phản ứng này đóng vai trò quan trọng trong việc bảo vệ môi trường và sức khỏe con người.
2. Điều kiện xảy ra phản ứng H2S + H2SO4 → SO2 + H2O + S:
Phản ứng H2S + H2SO4 → SO2 + H2O + S là một phản ứng hóa học quan trọng trong đời sống và sản xuất. Tuy nhiên, để phản ứng này xảy ra, cần phải đáp ứng đủ các điều kiện sau:
– Trong quá trình phản ứng H2S + H2SO4 → SO2 + H2O + S, cần phải có sự hiện diện của H2S và H2SO4 trong cùng một không gian. Điều này là để tạo điều kiện cho các phân tử này tương tác với nhau và xảy ra phản ứng.
– Nhiệt độ cũng là một yếu tố quan trọng trong quá trình này. Nhiệt độ phải đạt đủ để kích thích phản ứng xảy ra là ở nhiệt độ thường. Nếu nhiệt độ không đạt đủ thì phản ứng sẽ không thể xảy ra hoặc sẽ xảy ra rất chậm. Điều này là do nhiệt độ có ảnh hưởng đến năng lượng của các phân tử, nếu năng lượng không đạt đủ thì phản ứng sẽ không thể xảy ra.
– Điều kiện cuối cùng cần có để phản ứng xảy ra là phải có môi trường oxy hoá. Chất xúc tác cũng rất quan trọng trong quá trình này, cần có sự hiện diện của chất xúc tác như Fe2O3, V2O5, CuO… Điều này giúp cho phản ứng diễn ra nhanh chóng hơn và hiệu quả hơn. Chất xúc tác có tác dụng làm tăng tốc độ phản ứng bằng cách giảm độ khó của các phản ứng trung gian.
Để giải thích rõ hơn về quá trình phản ứng H2S + H2SO4 → SO2 + H2O + S, ta có thể sử dụng một ví dụ cụ thể:
Giả sử chúng ta có một bể chứa H2S và H2SO4. Trước khi thực hiện phản ứng, ta cần đảm bảo rằng nhiệt độ của bể chứa đạt đủ để kích thích phản ứng xảy ra. Sau đó, ta cần thêm chất xúc tác vào bể chứa để tăng tốc độ phản ứng. Nếu tất cả các điều kiện trên được đáp ứng đầy đủ, phản ứng H2S + H2SO4 → SO2 + H2O + S sẽ xảy ra nhanh chóng và hiệu quả.
Tuy nhiên, nếu thiếu bất kỳ một điều kiện trên, phản ứng sẽ không thể xảy ra hoặc sẽ xảy ra rất chậm. Vì vậy, để đảm bảo quá trình phản ứng xảy ra hiệu quả, cần phải đáp ứng đủ các yếu tố trên. Việc tạo ra một môi trường phản ứng đúng cách là rất quan trọng trong quá trình sản xuất các hợp chất hóa học và các sản phẩm công nghiệp khác.
3. Ứng dụng của phản ứng H2S + H2SO4 → SO2 + H2O + S:
Phản ứng H2S + H2SO4 → SO2 + H2O + S được biết đến như một trong những phản ứng quan trọng trong ngành hóa học, vì tính linh hoạt của nó trong việc tạo ra nhiều sản phẩm khác nhau, có nhiều ứng dụng trong các ngành công nghiệp và sản xuất. Dưới đây là một số ứng dụng của phản ứng này:
3.1. Sản xuất axit sunfuric:
Phản ứng H2S + H2SO4 → SO2 + H2O + S là một bước quan trọng trong quá trình sản xuất axit sunfuric. SO2 được sản xuất trong phản ứng này là nguyên liệu chính để sản xuất axit sunfuric. Axit sunfuric là một trong những loại axit quang trọng nhất trong ngành công nghiệp. Nó được sử dụng để sản xuất các sản phẩm hóa học khác nhau như phân bón, thuốc trừ sâu, chất tẩy rửa, nhựa và cả pin điện thoại. Axit sunfuric còn được sử dụng trong quá trình sản xuất kim loại, trong đó nó được sử dụng để tẩy sạch các chất gây ô nhiễm và giúp tăng độ trong suốt của kim loại.
3.2. Khử màu:
Sulfur được tạo ra trong quá trình phản ứng có tính khử mạnh, do đó nó có thể được sử dụng để khử màu các chất hữu cơ, ví dụ như thuốc nhuộm và mực in. Điều này giúp tăng tính thẩm mỹ cho các sản phẩm và cải thiện chất lượng của chúng. Sulfur cũng được sử dụng để giảm mùi hôi trong các ứng dụng khác nhau.
3.3. Tẩy trắng giấy:
Sulfur cũng được sử dụng để tẩy trắng giấy. Trong quá trình sản xuất giấy, các tế bào gỗ tạo ra lignin, một chất gây màu nâu. Sulfur có thể được sử dụng để tẩy trắng giấy bằng cách tạo ra một phản ứng oxi-hoá và khử. Quá trình này giúp tăng độ trắng sáng của giấy và giảm thiểu sự sử dụng hóa chất độc hại trong quá trình sản xuất giấy. Điều này giúp tăng tính thẩm mỹ và giảm thiểu tác động tiêu cực đến môi trường.
3.4. Sản xuất lưu huỳnh:
Trong quá trình phản ứng H2S + H2SO4 → SO2 + H2O + S, lưu huỳnh được tạo ra và có thể được sử dụng trong các ứng dụng khác nhau, bao gồm sản xuất phân bón và thuốc trừ sâu. Lưu huỳnh là một nguyên liệu phổ biến trong ngành nông nghiệp, được sử dụng để tăng cường chất lượng đất và giúp cây trồng phát triển tốt hơn.
3.5. Sản xuất thuốc trừ sâu:
SO2 được tạo ra trong phản ứng này là một thành phần quan trọng của hầu hết các loại thuốc trừ sâu. SO2 có tính khử trùng và có thể giúp bảo vệ các sản phẩm nông nghiệp khỏi nhiều loại côn trùng và vi khuẩn gây hại. Việc sử dụng SO2 trong sản xuất thuốc trừ sâu giúp tăng hiệu quả của các sản phẩm và giảm thiểu sự sử dụng các hóa chất độc hại khác. Các sản phẩm được sản xuất từ phản ứng này giúp bảo vệ các vùng trồng trọt khỏi các loại sâu bệnh và giúp cây trồng phát triển tốt hơn.
3.6. Sản xuất chất tẩy rửa:
Sulfur cũng được sử dụng để sản xuất các chất tẩy rửa như detergent. Sulfur có khả năng tẩy sạch và khử trùng, do đó nó là một thành phần quan trọng trong các sản phẩm tẩy rửa.
3.7. Sản xuất nhựa:
Sulfur cũng được sử dụng để sản xuất các loại nhựa. Các loại nhựa này có tính chất khác nhau tùy vào cách sử dụng và sản xuất. Nhựa có thể được sử dụng trong nhiều ngành công nghiệp khác nhau, bao gồm ngành sản xuất ô tô, điện tử và y tế. Với tính linh hoạt đa dạng này, phản ứng H2S + H2SO4 → SO2 + H2O + S là một phản ứng quan trọng trong việc tạo ra các sản phẩm có tính chất khác nhau và có nhiều ứng dụng trong đời sống và sản xuất.
4. Câu hỏi liên quan:
Câu 1. Khẳng định nào sau đây là đúng khi nói về tính chất hóa học của hiđro sunfua.
A. Tính axit mạnh và tính khử yếu.
B. Tính bazơ yếu và tính oxi hóa mạnh.
C. Tính bazơ yếu và tính oxi hóa yếu.
D. Tính axit yếu và tính khử mạnh.
Đáp án D
Câu 2. Vì sao không thể sử dụng H2SO4 đặc làm khô khí H2S
A. Vì H2SO4 đặc phản ứng với H2S
B. Vì H2SO4 là chất oxi hóa mạnh
C. Vì H2SO4 không phản ứng với H2S
D. Vì H2SO4 là chất khử mạnh
Đáp án A
Câu 3. Dẫn khí H2S vào dung dịch KMnO4 và H2SO4 loãng, hiện tượng quan sát được là:
A. Dung dịch không màu chuyển sang màu tím
B. Dung dịch màu tím bị vẩn đục màu vàng
C. Màu tím của dung dịch KMnO4 chuyển sang màu vàng
D. Màu tím của dung dịch KMnO4 chuyển sang không màu và có vẩn đục màu vàng
Đáp án D
Câu 4. Khí SO2 (sinh ra từ việc đốt các nhiên liệu hóa thạch, quặng sunfua) là một trong những chất gây ô nhiễm môi trường, do SO2 trong không khí sinh ra:
A. mưa axit
B. hiện tượng nhà kính
C. lỗ thủng tầng ozon
D. nước thải gây ung thư
Đáp án A
Câu 5. Để nhận biết SO2 và SO3 người ta dùng thuốc thử:
A. Nước Cl2
B. dung dịch Ca(OH)2
C. Dung dịch Br2
D. dung dịch NaOH
Đáp án C
Câu 6. Hấp thụ 4,48 lít SO2 (đktc) vào 150 ml dung dịch NaOH 2M, thu được dung dịch chứa m gam muối. Giá trị của m là
A. 18,9
B. 25,2
C. 20,8
D. 23,0
Đáp án D
Câu 7. Phương trình nào sau đây thể hiện tính khử của SO2?
A. SO2 + KOH → KHSO3
B. SO2 + Br2 + 2H2O → H2SO4
C. SO2 + CaO → CaCO3
D. SO2 + 2KOH → K2SO3 + H2O
Đáp án B
Câu 8. Để nhận biết hai khí SO2và O2 ta dùng
A. quỳ tím ẩm.
B. dung dịch Ca(OH)2.
C. dung dịch Ba(OH)2.
D. cả A, B, C đều đúng.
Đáp án D
Câu 9. Dẫn hỗn hợp khí gồm CO2, CO, SO2 lội qua dung dịch nước vôi trong (dư), khí thoát ra là:
A. CO
B. CO2
C. SO2
D. CO2 và SO2
Đáp án A
Câu 10. Dẫn hỗn hợp khí gồm SO2, NO2, NO, CO qua bình đựng dung dịch Ca(OH)2 dư. Khí thoát ra là khí nào?
A. NO và CO
B. NO2 và CO2
C. NO2 và CO
D. N2O5 và SO3
Đáp án A
Câu 11. Hỗn hợp khí X gồm: O2, Cl2, CO2, SO2. Dẫn X từ từ vào bình đựng dung dịch Ca(OH)2 dư. Chất khí thoát ra khỏi dung dịch là
A. Cl2
B. CO2.
C. SO2.
D. O2
Đáp án D
Câu 12. Các đồ vật bằng bạc để lâu trong không khí thường bị xỉn màu đen. Nguyên nhân gây ra hiện tượng này là do:
A. Bạc tác dụng với O2 trong không khí.
B. Bạc tác dụng với hơi nước.
C. Bạc tác dụng đồng thời với khí O2 và H2S trong không khí.
D. Bạc tác dụng với khí CO2.
Đáp án C