Mục lục bài viết
- 1 1. Phản ứng hoá học Fe + CuCl2 → Cu + FeCl2 | Fe ra FeCl2:
- 2 2. Phân tích phản ứng hóa học Fe + CuCl2 → Cu + FeCl2:
- 2.1 2.1. Điều kiện để xảy ra phản ứng hóa học Fe + CuCl2 → Cu + FeCl2:
- 2.2 2.2. Nhận biết phản ứng hóa học Fe + CuCl2 → Cu + FeCl2:
- 2.3 2.3. Phương trình ion của phản ứng hóa học Fe + CuCl2 → Cu + FeCl2:
- 2.4 2.4. Thực hiện phản ứng hoá học Fe + CuCl2 → Cu + FeCl2:
- 2.5 2.5. Cách cân bằng phương trình hóa học Fe + CuCl2 → Cu + FeCl2:
- 2.6 2.6. Ứng dụng của phản ứng hoá học Fe + CuCl2 → Cu + FeCl2:
- 3 3. Bài tập vận dụng liên quan:
1. Phản ứng hoá học Fe + CuCl2 → Cu + FeCl2 | Fe ra FeCl2:
Fe + CuCl2 → Cu + FeCl2
Đây là một phản ứng oxi hoá khử xảy ra giữa sắt và dung dịch đồng clorua. Khi cho sắt vào dung dịch đồng clorua, sắt sẽ bị oxi hoá thành sắt clorua, còn đồng trong dung dịch sẽ bị khử thành kim loại đồng. Fe có khả năng oxi hóa và Cu2+ có khả năng khử. Trong trường hợp này, Fe có thể oxi hóa được do tính chất hoạt động kim loại, còn Cu2+ có thể khử được do tính chất ion kim loại khử được.
Trong đó Fe bị oxi hóa từ trạng thái oxi hóa 0 thành +2, còn Cu2+ bị khử từ trạng thái oxi hóa +2 thành 0. Trong quá trình, Fe chuyển 2 electron cho Cu2+, làm cho Cu2+ bị khử thành Cu kim loại. Phản ứng còn tuân theo luật bảo toàn electron, tức là tổng số electron bị mất bên cạnh tổng số electron được nhận phải bằng nhau.
Phản ứng Fe ra FeCl2 có ý nghĩa trong việc tách đồng từ các quặng chứa đồng clorua.
2. Phân tích phản ứng hóa học Fe + CuCl2 → Cu + FeCl2:
2.1. Điều kiện để xảy ra phản ứng hóa học Fe + CuCl2 → Cu + FeCl2:
Phản ứng hóa học Fe + CuCl2 → Cu + FeCl2 xảy ra ngay trong điều kiện thường. Ngoài ra, cần cung cấp nhiệt độ và áp suất phù hợp để tăng tốc độ phản ứng.
2.2. Nhận biết phản ứng hóa học Fe + CuCl2 → Cu + FeCl2:
Để nhận biết phản ứng này, ta có thể quan sát hiện tượng sau:
– Đinh sắt tan dần trong dung dịch CuCl2, cho thấy sắt bị oxi hóa và tạo thành muối FeCl2.
– Xuất hiện lớp đồng màu đỏ gạch bám vào bề mặt đinh sắt, cho thấy đồng bị khử và tách ra khỏi muối CuCl2.
– Dung dịch CuCl2 có màu xanh dương nhạt dần và chuyển sang màu xanh lá cây do hình thành FeCl2.
2.3. Phương trình ion của phản ứng hóa học Fe + CuCl2 → Cu + FeCl2:
Để viết được phương trình ion, ta cần biết trạng thái của các chất trong phản ứng, tức là biết chúng là chất rắn, lỏng, khí hay dung dịch điện li. Trong trường hợp này, Fe là chất rắn, CuCl2 là dung dịch điện li tạo ra các ion Cu2+ và Cl-, Cu là chất rắn và FeCl2 là dung dịch điện li tạo ra các ion Fe2+ và Cl-. Do đó, ta có thể viết phương trình ion như sau:
Fe (s) + Cu2+ (aq) + 2Cl- (aq) → Cu (s) + Fe2+ (aq) + 2Cl- (aq)
Ta thấy rằng ion Cl- xuất hiện ở cả hai vế của phương trình, nghĩa là nó không thay đổi trong quá trình phản ứng. Do đó, ta có thể bỏ nó đi để được phương trình ion rút gọn:
Fe (s) + Cu2+ (aq) → Cu (s) + Fe2+ (aq)
Trong đó, Fe(s) là thanh sắt, Cu2+(aq) là ion đồng trong dung dịch CuCl2, Fe2+(aq) là ion sắt trong dung dịch FeCl2, và Cu(s) là kim loại đồng.
Pin hoá học là một thiết bị chuyển đổi năng lượng hoá học thành năng lượng điện. Trong trường hợp này, pin hoá học được tạo thành bởi hai điện cực: cực âm là thanh sắt, cực dương là dung dịch CuCl2. Giữa hai điện cực có một chất điện li, thường là muối như NaCl hay KCl, để duy trì sự trung hoà điện tích của dung dịch. Khi phản ứng xảy ra, các electron từ cực âm chuyển sang cực dương qua một mạch điện ngoài, tạo ra dòng điện. Kết tinh là quá trình hình thành các tinh thể rắn từ dung dịch hoặc khí. Trong phản ứng này, khi các ion Cu2+ nhận được electron từ thanh sắt, chúng trở thành nguyên tử đồng và không còn tan được trong dung dịch. Do đó, chúng sẽ kết tinh thành các tinh thể đồng trên bề mặt thanh sắt. Có thể thấy được hiện tượng ấy bằng mắt thường khi quan sát thanh sắt có màu đỏ của kim loại đồng.
2.4. Thực hiện phản ứng hoá học Fe + CuCl2 → Cu + FeCl2:
Để thực hiện phản ứng này, ta cần chuẩn bị một miếng sắt, một bình chứa dung dịch CuCl2, một dây điện và một nguồn điện. Sau đó, ta thực hiện các bước sau:
– Cắt miếng sắt thành hai phần nhỏ, gắn vào hai đầu của dây điện.
– Nối dây điện với nguồn điện, để tạo ra một mạch điện đóng.
– Nhúng hai miếng sắt vào dung dịch CuCl2, để tạo ra hai điện cực của một quá trình điện phân.
– Quan sát hiện tượng xảy ra trên bề mặt của hai miếng sắt. Ta sẽ thấy miếng sắt nối với cực âm của nguồn điện bị ăn mòn và phát ra khí hidro (H2), trong khi miếng sắt nối với cực dương của nguồn điện bám lên các hạt đồng kim loại, màu của dung dịch từ xanh lam dần chuyển sang xanh lục.
– Sau khi phản ứng kết thúc, ta thu được hai sản phẩm: đồng kim loại và dung dịch sắt clorua. Ta có thể lọc đồng kim loại ra khỏi dung dịch bằng cách sử dụng một giấy lọc hoặc một kẹp từ.
2.5. Cách cân bằng phương trình hóa học Fe + CuCl2 → Cu + FeCl2:
Fe + CuCl2 → Cu + FeCl2
Cách lập phương trình hóa học:
– Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa – chất khử:
![]()
Chất khử: Fe; chất oxi hoá: CuCl2.
– Bước 2: Biểu diễn quá trình oxi hóa, quá trình khử
+ Quá trình oxi hóa: ![]()
+ Quá trình khử: ![]()
– Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa.
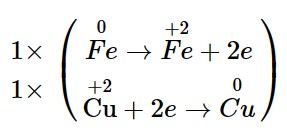
– Bước 4: Điền hệ số của các chất có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
Fe + CuCl2 → Cu + FeCl2
2.6. Ứng dụng của phản ứng hoá học Fe + CuCl2 → Cu + FeCl2:
Phản ứng này có nhiều ứng dụng trong cuộc sống, chẳng hạn như:
– Trong công nghiệp, được dùng để sản xuất đồng kim loại từ muối clorua đồng.
– Trong phòng thí nghiệm, được dùng để kiểm tra tính chất của các chất tham gia và sản phẩm, cũng như để xác định vị trí của các kim loại trong dãy hoạt động hóa học.
– Trong cuộc sống, được dùng để tẩy trắng gỗ bằng cách trộn CuCl2 với FeCl2 và một chất làm trắng khác như Ca(OCl)2.
3. Bài tập vận dụng liên quan:
Câu 1: Phản ứng hóa học Fe + CuCl2 → Cu + FeCl2 là phản ứng gì?
A. Phản ứng oxi hóa khử
B. Phản ứng thế
C. Phản ứng trao đổi ion
D. Cả A và B đều đúng
Đáp án: D.
Câu 2: Trong phản ứng Fe + CuCl2 → Cu + FeCl2, chất nào bị oxi hóa?
A. Fe
B. Cu
C. Cl
D. Không có chất nào bị oxi hóa
Đáp án: A
Câu 3: Trong phản ứng Fe + CuCl2 → Cu + FeCl2, chất nào bị khử?
A. Fe
B. Cu
C. Cl
D. Không có chất nào bị khử
Đáp án: B
Câu 4: Trong phản ứng Fe + CuCl2 → Cu + FeCl2, số oxi hóa của Fe thay đổi như thế nào?
A. Tăng từ 0 lên 2
B. Giảm từ 0 xuống -2
C. Tăng từ -2 lên 0
D. Giảm từ 2 xuống 0
Đáp án: A
Câu 5: Trong phản ứng Fe + CuCl2 → Cu + FeCl2, số oxi hóa của Cu thay đổi như thế nào?
A. Tăng từ 0 lên 2
B. Giảm từ 0 xuống -2
C. Tăng từ -2 lên 0
D. Giảm từ 2 xuống 0
Đáp án: D
Câu 6: Trong phản ứng Fe + CuCl2 → Cu + FeCl2, số oxi hóa của Cl thay đổi như thế nào?
A. Tăng từ -1 lên 1
B. Giảm từ -1 xuống -3
C. Tăng từ -3 lên -1
D. Không thay đổi
Đáp án: D
Câu 7: Để xác định số mol của mỗi chất trong phản ứng Fe + CuCl2 → Cu + FeCl2, ta cần biết thông tin gì?
A. Khối lượng mol của mỗi chất
B. Hệ số mol của mỗi chất trong phương trình cân bằng
C. Nồng độ mol của mỗi chất trong dung dịch
D. Cả A và B đều cần thiết
Đáp án: D
Câu 8: Nếu cho 5,6 gam Fe tác dụng với dung dịch CuCl2 dư, thì khối lượng Cu thu được là bao nhiêu?
A. 4 gam
B. 8 gam
C. 12 gam
D. Không thể tính được vì thiếu thông tin về nồng độ dung dịch CuCl2
Đáp án: B
Câu 9: Nếu cho dung dịch CuCl2 có nồng độ mol là 0,5 M tác dụng với thanh sắt dư, thì thể tích dung dịch cần dùng để thu được 6,4 gam Cu là bao nhiêu?
A. 100 ml
B. 200 ml
C. 300 ml
D. Không thể tính được vì thiếu thông tin về khối lượng mol của sắt
Đáp án: B
Câu 10: Nếu cho dung dịch CuCl2 có nồng độ mol là x M tác dụng với thanh sắt có khối lượng mol là y mol, thì giá trị của x và y để thu được nhiều nhất khối lượng Cu là bao nhiêu?
A. x = y = 1/4,8 M
B. x = y = 1/9,6 M
C. x = y = 1/19,2 M
D. Không thể tính được vì thiếu thông tin về khối lượng mol của Cu
Đáp án: A




