Cân bằng các phản ứng sau theo phương pháp thăng bằng được biên soạn chi tiết dễ hiểu hướng dẫn bạn đọc cân bằng phương trình phản ứng oxi hóa khử bằng phương pháp thăng bằng electron. Mời các bạn cùng theo dõi bài viết dưới đây.
Mục lục bài viết
1. Cách cân bằng phản ứng bằng phương pháp thăng bằng electron:
Cách cân bằng phản ứng bằng phương pháp thăng bằng electron là một kỹ thuật hóa học được sử dụng để cân bằng các phương trình phản ứng oxi hóa khử. Phương pháp này dựa trên việc xác định số oxi hóa của các nguyên tố trong các chất tham gia và sản phẩm, và điều chỉnh số lượng electron mất hoặc nhận của chúng để bảo toàn điện tích. Các bước cơ bản của phương pháp này là:
– Viết phương trình phản ứng chưa cân bằng, chỉ ghi các chất tham gia và sản phẩm, không cần ghi các hệ số.
– Xác định số oxi hóa của các nguyên tố trong các chất tham gia và sản phẩm, và ghi chúng dưới dạng số mũ.
– Xác định các nguyên tố bị oxi hóa (tăng số oxi hóa) và khử (giảm số oxi hóa), và ghi chúng dưới dạng hai nửa phương trình riêng biệt.
– Đối với mỗi nửa phương trình, cân bằng số nguyên tử của nguyên tố bị oxi hóa hoặc khử, sau đó cân bằng số electron mất hoặc nhận bằng cách thêm electron vào vế thích hợp.
– Cân bằng số electron mất và nhận giữa hai nửa phương trình bằng cách nhân các hệ số thích hợp cho mỗi nửa phương trình.
– Cộng hai nửa phương trình lại để được phương trình phản ứng hoàn chỉnh, sau đó kiểm tra lại xem có cân bằng về số nguyên tử, điện tích và electron hay không.
– Nếu có thể, rút gọn các chất giống nhau xuất hiện ở cả hai vế của phương trình, hoặc đơn giản hóa các hệ số bằng cách chia cho ước chung lớn nhất.
2. Quy tắc xác định số oxi hóa:
Quy tắc xác định số oxi hóa là một phương pháp hóa học để biết được số electron mà một nguyên tử hoặc một nhóm nguyên tử nhận hoặc cho đi khi tham gia vào một phản ứng hóa học. Quy tắc xác định số oxi hóa có thể được tóm tắt như sau:
– Số oxi hóa của một nguyên tố đơn giản là bằng không.
– Số oxi hóa của một ion đơn giản là bằng điện tích của ion đó.
– Số oxi hóa của các nguyên tố trong một hợp chất phải cộng lại bằng không.
– Số oxi hóa của các ion trong một phức chất phải cộng lại bằng điện tích của phức chất đó.
– Số oxi hóa của oxy trong hợp chất thường là -2, trừ khi nó kết hợp với fluor (số oxi hóa là +2) hoặc nó ở dạng peroxit (số oxi hóa là -1).
– Số oxi hóa của hydro trong hợp chất thường là +1, trừ khi nó kết hợp với kim loại (số oxi hóa là -1).
– Số oxi hóa của các nguyên tố nhóm halogen thường là -1, trừ khi nó kết hợp với oxy hoặc các nguyên tố có số oxi hóa cao hơn nó.
– Số oxi hóa của các nguyên tố khác có thể thay đổi tùy thuộc vào trạng thái oxy hóa của chúng. Một số quy tắc cụ thể có thể được tra cứu trong bảng tuần hoàn.
3. Bài tập về cân bằng phản ứng bằng phương pháp thăng bằng electron:
Bài 1: Cân bằng phản ứng hóa học H2O2 ![]() H2O + O2
H2O + O2
– Bước 1. Viết ra phương trình chưa cân bằng của phản ứng hóa học. Để có kết quả tốt hơn, hãy viết phản ứng ở dạng ion.
H2O2 ![]() H2O + O2
H2O + O2
– Bước 2. Tách phản ứng oxy hóa khử thành một nửa phản ứng. Phản ứng oxy hóa khử không có tác dụng gì ngoài cả phản ứng oxy hóa và khử diễn ra đồng thời.
a) Gán số oxy hóa cho từng nguyên tử trong phương trình. Số oxy hóa (còn gọi là trạng thái oxy hóa) là thước đo mức độ oxy hóa của một nguyên tử trong một chất.
![]()
b) Xác định và viết ra tất cả các cặp oxy hóa khử trong phản ứng. Xác định chất phản ứng nào đang bị oxy hóa (số lượng oxy hóa tăng lên khi nó phản ứng) và chất nào đang bị khử (số oxy hóa giảm xuống).
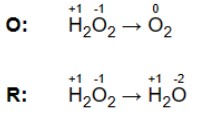
c) Kết hợp các cặp oxy hóa khử này thành hai nửa phản ứng: một cho quá trình oxy hóa và một để khử.
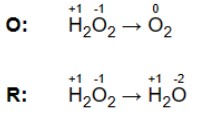
– Bước 3. Cân bằng các nguyên tử trong mỗi nửa phản ứng. Một phương trình hóa học phải có cùng số nguyên tử của mỗi nguyên tố ở cả hai phía của phương trình. Thêm các hệ số thích hợp (hệ số cân bằng) trước các công thức hóa học. Không bao giờ thay đổi công thức khi cân bằng phương trình. Cân bằng từng nửa phản ứng riêng biệt.
a) Cân bằng tất cả các nguyên tử khác trừ hydro và oxy. Hãy nhớ rằng các chất phản ứng chỉ nên được thêm vào phía bên trái của phương trình và các chất sản phẩm ở phía bên phải.
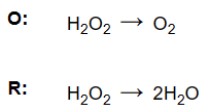
b) Cân bằng các nguyên tử oxy. Kiểm tra xem có cùng số lượng nguyên tử oxy ở bên trái và bên phải hay không, nếu chúng không cân bằng thì thêm hệ số vào phân tử nước.
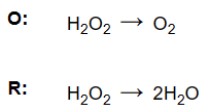
c) Cân bằng các nguyên tử hydro. Kiểm tra xem có cùng số nguyên tử hydro ở bên trái và bên phải hay không, nếu chúng không cân bằng thì thêm proton (H +).
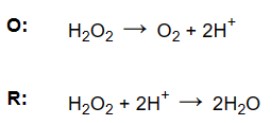
– Bước 4. Cân bằng điện tích. Để cân bằng điện tích, thêm các electron (e-) vào phía dương hơn để bằng với mặt ít dương hơn của nửa phản ứng. Không quan trọng điện tích là bao nhiêu miễn là nó giống nhau ở cả hai bên.
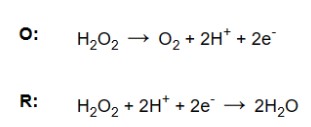
– Bước 5. Làm cho electron tương đương với electron bị mất. Các electron bị mất trong nửa phản ứng oxy hóa phải bằng các electron thu được trong nửa phản ứng khử. Để làm cho cả hai bằng nhau, nhân các hệ số của tất cả các bên với các số nguyên tạo ra bội số chung thấp nhất giữa các nửa phản ứng.
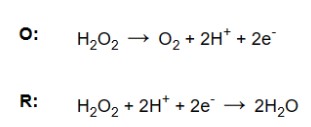
– Bước 6. Cộng các nửa phản ứng lại với nhau. Kết hợp lại hai nửa phản ứng bằng cách thêm tất cả các chất phản ứng lại với nhau ở một bên và tất cả các sản phẩm với nhau ở phía bên kia.
![]()
– Bước 7. Đơn giản hóa phương trình. Các nguyên tố giống nhau ở hai bên đối diện của mũi tên có thể bị hủy bỏ. Viết phương trình sao cho các hệ số là tập hợp số nguyên nhỏ nhất có thể.
![]()
Bài 2: Cân bằng phản ứng hóa học ![]()
– Bước 1. Viết ra phương trình chưa cân bằng của phản ứng hóa học. Để có kết quả tốt hơn, hãy viết phản ứng ở dạng ion.
![]()
– Bước 2. Tách phản ứng oxy hóa khử thành một nửa phản ứng. Phản ứng oxy hóa khử không có tác dụng gì ngoài cả phản ứng oxy hóa và khử diễn ra đồng thời.
a) Gán số oxy hóa cho từng nguyên tử trong phương trình. Số oxy hóa (còn gọi là trạng thái oxy hóa) là thước đo mức độ oxy hóa của một nguyên tử trong một chất.
![]()
b) Xác định và viết ra tất cả các cặp oxy hóa khử trong phản ứng. Xác định chất phản ứng nào đang bị oxy hóa (số lượng oxy hóa tăng lên khi nó phản ứng) và chất nào đang bị khử (số oxy hóa giảm xuống).
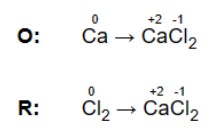
c) Kết hợp các cặp oxy hóa khử này thành hai nửa phản ứng: một cho quá trình oxy hóa và một để khử.
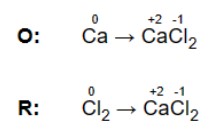
– Bước 3. Cân bằng các nguyên tử trong mỗi nửa phản ứng. Một phương trình hóa học phải có cùng số nguyên tử của mỗi nguyên tố ở cả hai phía của phương trình. Thêm các hệ số thích hợp (hệ số cân bằng) trước các công thức hóa học. Không bao giờ thay đổi công thức khi cân bằng phương trình. Cân bằng từng nửa phản ứng riêng biệt.
a) Cân bằng tất cả các nguyên tử khác trừ hydro và oxy. Hãy nhớ rằng các chất phản ứng chỉ nên được thêm vào phía bên trái của phương trình và các chất sản phẩm ở phía bên phải.
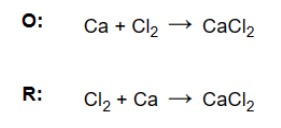
b) Cân bằng các nguyên tử oxy. Kiểm tra xem có cùng số lượng nguyên tử oxy ở bên trái và bên phải hay không, nếu chúng không cân bằng thì thêm hệ số vào phân tử nước.
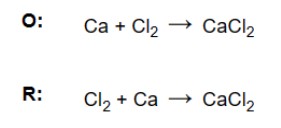
c) Cân bằng các nguyên tử hydro. Kiểm tra xem có cùng số nguyên tử hydro ở bên trái và bên phải hay không, nếu chúng không cân bằng thì thêm proton (H +).
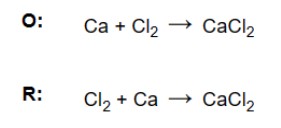
– Bước 4. Cân bằng điện tích. Để cân bằng điện tích, thêm các electron (e-) vào phía dương hơn để bằng với mặt ít dương hơn của nửa phản ứng. Không quan trọng điện tích là bao nhiêu miễn là nó giống nhau ở cả hai bên.
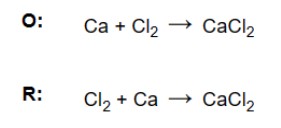
– Bước 5. Làm cho electron tương đương với electron bị mất. Các electron bị mất trong nửa phản ứng oxy hóa phải bằng các electron thu được trong nửa phản ứng khử. Để làm cho cả hai bằng nhau, nhân các hệ số của tất cả các bên với các số nguyên tạo ra bội số chung thấp nhất giữa các nửa phản ứng.
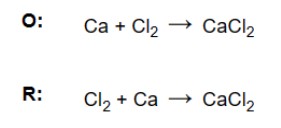
– Bước 6. Cộng các nửa phản ứng lại với nhau. Kết hợp lại hai nửa phản ứng bằng cách thêm tất cả các chất phản ứng lại với nhau ở một bên và tất cả các sản phẩm với nhau ở phía bên kia.
![]()
– Bước 7. Đơn giản hóa phương trình. Các nguyên tố giống nhau ở hai bên đối diện của mũi tên có thể bị hủy bỏ. Viết phương trình sao cho các hệ số là tập hợp số nguyên nhỏ nhất có thể.
![]()




