Axit cacboxylic là gì? Công thức chung, tính chất hóa học, vật lý của Axit cacboxylic? Làm thế nào để điều chế Axit cacboxylic? Xin mời các thầy cô cùng các em học sinh tìm hiểu bài viết dưới đây để có phương pháp dạy học và học tập tốt hơn.
Mục lục bài viết
1. Axit cacboxylic là gì?
1.1. Định nghĩa:
Axit cacboxylic là một nhóm hợp chất hữu cơ có chứa nhóm chức cacboxyl (-COOH) trong phân tử liên kết với một nguyên tử cacbon hoặc hidro. Nhóm này bao gồm nhiều hợp chất quan trọng như axit axetic (CH3COOH) hay axit benzoic (C6H5COOH). Nhóm chức này là nguồn gốc của tính axit của các hợp chất này, do có khả năng nhường proton (H+) cho dung dịch nước hoặc các bazơ. Axit cacboxylic có công thức tổng quát là R-COOH, trong đó R là gốc hiđrocacbon hoặc H.
Nhóm cacboxyl này bao gồm một nguyên tử carbon nằm giữa hai liên kết: một liên kết đôi carbon-oxy (C=O) và một liên kết đơn carbon-oxy (C-OH).
Một số ví dụ về axit cacboxylic là: axit fomic (H-COOH), axit axetic (CH3-COOH), axit benzoic (C6H5-COOH), axit oxalic (HOOC-COOH),…
1.2. Phân loại:
– Axit no đơn chức: Các axit này có công thức tổng quát là CnH2n+1COOH (n ≥ 0) hoặc CmH2mO2 (m ≥ 1). Ví dụ: axit axetic (CH3COOH).
– Axit không no đơn chức: Các axit này có một nhóm chức cacboxyl (-COOH) được gắn vào một gốc hydrocacbon không no. Ví dụ: axit benzoic (C6H5COOH).
– Axit thơm, đơn chức: Các axit này có một nhóm chức cacboxyl (-COOH) được gắn vào một vòng benzen. Ví dụ: axit salicylic (C6H4(OH)COOH).
– Axit đa chức: Các axit này có nhiều nhóm chức cacboxyl (-COOH) trong phân tử. Ví dụ: axit oxalic (HOOC-COOH).
Lưu ý rằng đây chỉ là một số phân loại cơ bản của axit cacboxylic. Có nhiều loại axit cacboxylic khác nhau dựa trên cấu trúc và tính chất hóa học của chúng.
1.3. Danh pháp:
Danh pháp của axit cacboxylic là một cách đặt tên cho các hợp chất hữu cơ có chứa nhóm cacboxyl (-COOH). Các axit cacboxylic có thể được phân loại theo số lượng nhóm cacboxyl trong phân tử, theo độ bão hòa của chuỗi cacbon, hoặc theo sự tham gia của các nguyên tố khác như oxy, nitơ, lưu huỳnh, v.v. Một số quy tắc chung cho danh pháp của axit cacboxylic là:
– Nếu chỉ có một nhóm cacboxyl trong phân tử, ta dùng tên gốc của chuỗi cacbon kết hợp với hậu tố -oic và tiền tố acid. Ví dụ: CH3COOH là acid acetic, CH3CH2COOH là acid propionic, v.v.
– Nếu có nhiều hơn một nhóm cacboxyl trong phân tử, ta dùng tiền tố đi- (hai), tri- (ba), tetra- (bốn), v.v. để chỉ số lượng nhóm cacboxyl, và dùng các số La Mã để chỉ vị trí của chúng trên chuỗi cacbon. Ví dụ: HOOC-COOH là acid đi-oxalic, HOOC-CH2-COOH là acid tri-oxalic, HOOC-(CH2)2-COOH là acid tetra-oxalic, v.v.
– Nếu chuỗi cacbon có các liên kết đôi hoặc ba, ta dùng các hậu tố -enoic hoặc -ynoic để chỉ sự bão hòa của chuỗi. Ví dụ: CH2=CH-COOH là acid acrylic (acid 2-propenoic), HC≡C-COOH là acid propiolic (acid 2-propynoic), v.v.
– Nếu có các nguyên tố khác tham gia vào phân tử, ta dùng các tiền tố hoặc hậu tố để chỉ sự hiện diện của chúng. Ví dụ: CH3-CH(OH)-COOH là acid lactic (acid 2-hydroxypropanoic), CH3-CO-NH2 là acid amide (acid etanoamide), CH3-CH(SH)-COOH là acid thioglycolic (acid 2-mercaptoethanoic), v.v.
Các axit cacboxylic có vai trò quan trọng trong nhiều lĩnh vực như sinh học, y học, công nghiệp, v.v. Chúng tham gia vào nhiều phản ứng hóa học như thủy phân, este hóa, trùng ngưng, v.v. và có nhiều tính chất đặc trưng như tính axit, mùi, tan trong nước, v.v.
2. Tính chất vật lý và tính chất hóa học:
2.1. Tính chất vật lý:
– Các axit cacboxylic có nhóm chức -COOH có khả năng tạo liên kết hiđro với nhau và với nước, do đó có nhiệt độ sôi cao hơn các anđehit, xeton và ancol có cùng số nguyên tử cacbon.
– Các axit cacboxylic có từ 1 đến 3 nguyên tử cacbon tan vô hạn trong nước, từ 4 đến 5 nguyên tử tan ít, từ 6 trở lên không tan do gốc R cồng kềnh và kị nước.
– Các axit cacboxylic có mùi đặc trưng, thường là mùi chua hoặc hôi. Mùi này do các phân tử axit cacboxylic tạo thành các liên kết hiđrô với nhau và với nước, làm giảm độ bay hơi của chúng.
– Có nhiệt độ sôi cao hơn các hợp chất hữu cơ khác cùng số nguyên tử cacbon. Điều này cũng do sự tạo thành các liên kết hiđrô giữa các phân tử axit cacboxylic.
– Tan tốt trong nước ở nồng độ thấp, do khả năng tạo liên kết hiđrô với phân tử nước. Tuy nhiên, khi nồng độ axit cacboxylic tăng lên, khả năng tan của chúng giảm dần, do sự cạnh tranh về liên kết hiđrô giữa các phân tử axit cacboxylic với nhau và với nước.
– Tan được trong các dung môi hữu cơ phân cực, như ete, etanol, axeton, benzen, cloroform, vv, do khả năng tạo liên kết hiđrô với các phân tử dung môi phân cực.
– Không tan được trong các dung môi hữu cơ không phân cực, như hexan, heptan, vv. Bởi sự khác biệt về độ phân cực giữa các phân tử axit cacboxylic và dung môi không phân cực.
2.2. Tính chất hóa học:
– Tính axit:
Axit cacboxylic phân li thuận nghịch trong dung dịch nước, tạo ra ion H+ và ion cacboxylat.
Ví dụ: CH3COOH ⇄ H+ + CH3COO-.
Axit cacboxylic có tính axit nên làm quỳ tím chuyển thành màu đỏ.
Tính axit của axit cacboxylic phụ thuộc vào cấu trúc phân tử, càng nhiều nhóm thế có hiệu ứng -I (giảm điện tích của nguyên tử oxi) thì tính axit càng cao.
– Tác dụng với bazơ:
Axit cacboxylic tác dụng với bazơ tạo ra muối và nước.
Ví dụ: CH3COOH + NaOH → CH3COONa + H2O.
Muối của axit cacboxylic có tên gọi là muối cacboxylat .
– Tác dụng với oxit bazơ:
Axit cacboxylic tác dụng với oxit bazơ cũng tạo ra muối và nước.
Ví dụ: 2CH3COOH + CaO → (CH3COO)2Ca + H2O
– Tác dụng với kim loại đứng trước hidro trong dãy hoạt động hóa học:
Axit cacboxylic tác dụng với kim loại như Na, K, Mg, Al… tạo ra muối và khí hidro.
Ví dụ: 2CH3COOH + Mg → (CH3COO)2Mg + H2
– Tác dụng với muối của axit yếu hơn:
Axit cacboxylic có thể thay thế axit yếu hơn trong muối của chúng, tạo ra muối mới và axit mới.
Ví dụ: CH3COOH + NaHCO3 → CH3COONa + H2O + CO2
– Phản ứng thế nhóm OH:
Phản ứng thế nhóm OH của Axit cacboxylic là một phản ứng hóa học quan trọng trong tổng hợp hữu cơ. Phản ứng này cho phép biến đổi axit cacboxylic thành các chất có nhóm chức khác như este, anhydrit, clorua axit, amit, v.v. Phản ứng thế nhóm OH của Axit cacboxylic có thể xảy ra theo nhiều cơ chế khác nhau tùy thuộc vào điều kiện phản ứng và chất tham gia.
Một số ví dụ về phản ứng thế nhóm OH của Axit cacboxylic là:
+ Phản ứng este hóa: Khi đun sôi hỗn hợp gồm axit cacboxylic RCOOH và ancol R’OH với chất xúc tác H2SO4 đặc, nhóm OH của axit sẽ bị thế bởi nhóm OR’ của ancol, tạo ra este RCOOR’ và nước. Phản ứng này thuận nghịch và có thể đảo ngược bằng cách thủy phân este.
RCOOH + R’OH ⇔ RCOOR’ + H2O
+ Phản ứng tạo anhydrit: Khi nung nóng hai phân tử axit cacboxylic cùng loại hoặc khác loại với chất xúc tác P2O5 hoặc H2SO4 đặc, hai nhóm OH của hai phân tử axit sẽ bị loại bỏ, tạo ra anhydrit và nước. Phản ứng này cũng thuận nghịch và có thể đảo ngược bằng cách thủy phân anhydrit.
RCOOH + R’COOH ⇔ (RCO)2O + H2O
+ Phản ứng tạo clorua axit: Khi cho axit cacboxylic tác dụng với PCl5, PCl3 hoặc SOCl2, nhóm OH của axit sẽ bị thế bởi nguyên tử Cl, tạo ra clorua axit và các sản phẩm phụ khác. Phản ứng này không thuận nghịch và có thể tiếp tục tạo ra các chất có nhóm chức khác như amit, este, v.v.
RCOOH + PCl5 → RCOCl + POCl3 + HCl
RCOOH + PCl3 → RCOCl + H3PO3
RCOOH + SOCl2 → RCOCl + SO2 + HCl
+ Phản ứng tạo amit: Khi cho axit cacboxylic tác dụng với NH3 hoặc các amin đơn chức RNH2 hoặc hai chức R2NH, nhóm OH của axit sẽ bị thế bởi nhóm NH2 hoặc NHR hoặc NR2, tạo ra amit và nước. Phản ứng này thuận nghịch và có thể đảo ngược bằng cách thủy phân amit.
RCOOH + NH3 ⇔ RCONH2 + H2O
RCOOH + RNH2 ⇔ RCONHR + H2O
RCOOH + R2NH ⇔ RCONR2 + H2O
3. Điều chế Axit cacboxylic:
Có nhiều phương pháp để điều chế axit cacboxylic, tùy thuộc vào nguyên liệu và sản phẩm mong muốn. Dưới đây là một số phương pháp điều chế axit cacboxylic phổ biến:
– Phản ứng giữa halogenua alkyl với kiềm cacbonat hoặc kiềm bicacbonat: R-X + M2CO3 → R-COO-M + MX
– Phản ứng oxy hóa các hợp chất hữu cơ có liên kết đôi hoặc ba: R-CH=CH2 + O2 → R-COOH + H2O
– Phản ứng thủy phân este: R-COOR’ + H2O → R-COOH + R’-OH
– Phản ứng thủy phân nitril: R-CN + H2O → R-COOH + NH3
– Phản ứng thủy phân amit: R-CONH2 + H2O → R-COOH + NH3
Axit cacboxylic có thể được nhận biết bằng các phương pháp sau:
– Axit cacboxylic làm quỳ tím chuyển sang màu đỏ
– Axit cacboxylic tác dụng với dung dịch AgNO3/NH3 tạo kết tủa trắng Ag2CO3
– Axit cacboxylic không no làm mất màu dung dịch thuốc tím hoặc nước brom
4. Ứng dụng Axit cacboxylic:
– Trong công nghiệp thực phẩm, axit cacboxylic được dùng làm phụ gia, chất bảo quản, chất điều hương vị và chất tạo màu. Ví dụ, axit sorbic và axit benzoic có tác dụng ngăn chặn sự phát triển của vi khuẩn và nấm mốc trong thực phẩm. Axit xitric được dùng làm chất làm chua và chất bảo quản trong đồ uống và mứt.
– Trong ngành dược, axit cacboxylic được dùng để tổng hợp các loại thuốc như thuốc hạ sốt, giảm đau, kháng sinh, kháng viêm và kháng kị ứng. Ví dụ, axit acetylsalicylic (hay còn gọi là aspirin) có tác dụng hạ sốt, giảm đau và làm loãng máu. Axit butyric hoặc butanoic có hoạt động trong quá trình tổng hợp hương liệu và một số loại thuốc.
– Trong các ngành công nghiệp khác, axit cacboxylic cũng có vai trò quan trọng. Ví dụ, axit formic được dùng làm chất khử trùng, chất xử lý vải dệt và làm chất khử axit. Axit salixylic được dùng để chế thuốc cảm, thuốc xoa bóp, giảm đau và làm đẹp da. Axit stearic được dùng để sản xuất xà phòng, nến và mỹ phẩm. Axit cacboxylic còn được dùng để sản xuất nhựa, chất bôi trơn, phẩm nhuộm và nông dược.
5. Bài tập vận dụng:
Câu 1: Đốt cháy 14,6 gam 1 axit no đa chức Y ta thu được 0,6 mol CO2 và 0,5 mol nước. Biết mạch cacbon là mạch thẳng. Cho biết công thức cấu tạo của Y
A. HOOC-COOH
B. HOOC-CH2-COOH
C. HOOC-C(CH2)2-COOH
D. HOOC-(CH2)4-COOH
Đáp án: D.
Giải thích:
Do axit đa chức => có 2 nhóm COOH trở lên
Mà axit mạch thằng => có không quá 2 nhóm COOH
=> Axit no, 2 chức, mạch thẳng CnH2n-2O4
=>naxit = nCO2 – nH2O = 0,1 mol
=> n = 6 => CTPT C6H10O4
=> HOOC-(CH2)4-COOH
Câu 2: Đốt cháy hết 1 thể tích hơi axit hữu cơ A được 3 thể tích hỗn hợp CO2 và hơi nước cùng điều kiện. Công thức cấu tạo của A là
A. HCOOH.
B. CH3COOH.
C. HOOC – COOH.
D. HOOC – CH2 – COOH.
Đáp án: C.
Ta có sơ đồ:
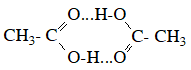
=> x + 0,5y = 3
=> x = 2 và y =2 thỏa mãn.
Vậy công thức cấu tạo của A là HOOC – COOH.
Câu 3: Chất X (có M = 60 và chứa C, H, O). Chất X phản ứng được với Na, NaOH, NaHCO3, tên gọi của X là
A. axit fomic.
B. metyl fomat.
C. axit axetic.
D. ancol propylic.
Đáp án: C.
Giải thích:
X phản ứng được với Na, NaOH, NaHCO3 nên X là axit.
Lại có MX = 60. Vậy X là axit axetic (CH3COOH).




