Amin là phần kiến thức vô cùng quan trọng trong chương trình hoá học lớp 12. Đây cũng là chuyên đề thường xuất hiện trong đề thi tốt nghiệp THPT môn hoá học. Vậy Amin là gì? Công thức cấu tạo, tính chất và ứng dụng của amin như thế nào? Dưới đây là phần hệ thống hóa kiến thức của amin.
Mục lục bài viết
1. Amin là gì?
Amin là hợp chất hữu cơ có nguyên tử gốc là Nitơ (đạm khí) trong nhóm chức. Khi thay thế một hay nhiều nguyên tử hidro trong phân tử NH3 bởi gốc hidrocacbon.
Ví dụ: CH3-NH-CH3, CH3-N-CH3, C6H5NH2, CH3-NH2.
Trong lĩnh vực hóa học, “amin” (hoặc “amine” trong tiếng Anh) là một loại hợp chất hữu cơ chứa nhóm chức amine (NH2) gắn vào một phân tử hữu cơ khác. Amin được xem xét là dẫn xuất của ammoniac (NH3), trong đó một hoặc nhiều nguyên tử hydro (H) trong ammoniac được thay thế bằng các nhóm chức amine hoặc các nhóm hydrocarbon khác.
Amin có thể được phân loại thành ba loại chính dựa trên số lượng nhóm chức amine gắn vào phân tử:
– Amin bậc 1 (hoặc amin bậc 1°): Có một nhóm chức amine (-NH2) gắn vào phân tử. Ví dụ: metylamine (CH3NH2).
– Amin bậc 2 (hoặc amin bậc 2°): Có hai nhóm chức amine gắn vào phân tử. Ví dụ: etylamine (C2H5NH2).
– Amin bậc 3 (hoặc amin bậc 3°): Có ba nhóm chức amine gắn vào phân tử. Ví dụ: isopropylamine (i-C3H7NH2).
Amin có một loạt ứng dụng trong hóa học, bao gồm làm tác nhân khử, tạo thành hợp chất hữu cơ phức tạp, và được sử dụng trong tổng hợp các hợp chất hữu cơ khác.
2. Phân loại Amin:
* Theo gốc Hidrocacbon:
Theo đặc điểm cấu tạo của gốc Hiđrocacbon ta có: amin thơm, amin béo và amin dị vòng.
Amin thơm: C6H5NH2, CH3C6H4NH2,…
Amin béo: C2H5NH2, CH3NH2.
Amin dị vòng.
* Theo bậc amin:
Bậc amin là số nguyên tử H trong phân tử NH3 bị thay thế bởi gốc hidrocacbon. Theo bậc amin thì các amin bao gồm: Amin bậc I, Amin bậc II và Amin bậc 3.
Amin bậc I: R-NH2 ( Dãy béo tác dụng với axit nito tạo thành alcohol tương ứng và giải phóng khí N2 )
Ví dụ: CH3-CH2-CH2-NH2
Amin bậc II: R-NH-R’ ( Dãy béo cùng dãy thơm tác dụng với axit nito sinh ra nitrosamin là những chất màu vàng, để phân biệt được amin bậc hai với amin bậc một ).
Ví dụ: CH3-CH2-NH-CH3
Amin bậc III: RN(R”)R’ ( Dãy béo không tác dụng với axit nito hoặc chỉ tạo thành muối không bền dễ bị thủy phân. Amin bậc 3 dãy thơm tác dụng với axit nitro cho sản phẩm thế ở nhân thơm ).
Ví dụ: (CH3)3N
* Công thức của Amin:
Công thức tổng quát: CxHyNz
K = ![]()
Amin đơn chức: CxHyN
Amin đơn chức no: CnH2n + 1NH2 hay CnH2n+3N. Công thức tính số đồng minh: 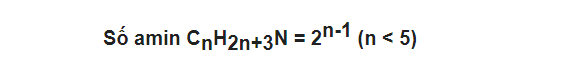
Amin đa chức no: CnH2n + 2-u(NH2)u hay CnH2n+2+uNu
3. Cách gọi tên Amin:
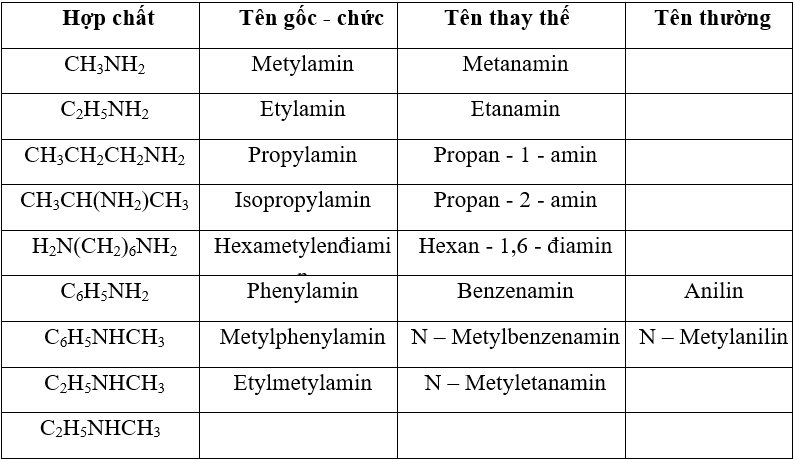
* Cách gọi tên theo danh pháp gốc – chức:
Tên gốc chức = gốc Hidrocacbon + amin.
Ví dụ: C2H5-NH2 ( đọc là Etylamin ), CH3NH2 ( đọc là metylamin),..
* Cách gọi tên theo danh pháp thay thế:
Tên thay thế = tên Hidrocacbon + vị trí + amin
Ví dụ: CH3NH2 ( đọc là metanamin ), C2H5-NH2 ( đọc là Etanamin )
Tên gọi thường chỉ áp dụng với một số amin:
4. Tính chất vật lý của Amin:
Amin là chất rắn, dạng tinh thể, không màu, vị hơi ngọt. Nhiệt độ nóng chảy cao, dễ tan trong nước (amino axit tồn tại ở dạng ion lưỡng cực)
Amin có khả năng tan trong nước, giữa nước và amin có liên kết hidro liên phân tử, độ tan trong nước giảm khi số nguyên tử cacbon tăng.
Metyl, dimetyl, trimetyl, etylamin là chất khí có mùi khai khó chịu, độc, tan dễ dàng trong nước , các amin đồng đẳng cao hơn là chất lỏng hoặc rắn.
Anilin là chất lỏng, nhiệt độ sôi là 184oC, rất độc, không màu, ít tan trong nước, tan trong ancol và benzen.
5. Tính chất hoá học của Amin:
Cấu tạo phân tử: các amin có tính bazơ giống NH3 (tức tính bazơ của amin = tính bazơ của NH3), (Do Amin đều có nguyên tử nito cần một cặp 2 tự do chứa liên kết giống NH3 dễ nhận proton H+)
=> Tính Bazo yếu.
* Tính bazo:
Tính bazo tác dụng lên giấy quỳ tím ẩm hoặc phenolphtalein và tác dụng với axit.
Dung dịch metylamin và nhiều đồng đẳng của nó có khả năng làm quỳ tím hoá màu xanh hoặc làm hồng phenolphtalein ( vì kết hợp proton mạnh hơn amoniac ). 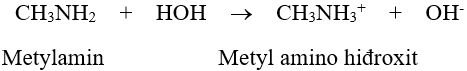
Amin bậc III mà gốc Hiđrocacbon có số C ≥ 2 thì các gốc R, R’ và R’’ cản trở amin nhận proton H+
=> tính bazơ yếu => dung dịch không làm quỳ tím đổi màu và phenolphtalein.
Anilin và các amin thơm sẽ không làm đổi màu quỳ tím và phenolphtalein. ( vì dung dịch này ít tan trong nước ).
– Tác dụng với axit:
Phương trình: R–NH2 + HCl → R–NH3Cl
– Tác dụng dung dịch muối của các kim loại có hiđroxit kết tủa (trừ Zn2+, Ni2+, Cu2+, Ag+ vì tạo phức):
Phương trình: 3CH3NH2 + FeCl3 + 3H2O → Fe(OH)3↓ + 3CH3NH3Cl
* Tác dụng với axit nitro HNO2:
Amin bậc I + HNO2 -> ROH + N2 + H2O
Phương trình: C2H5NH2 + NONO -> C2H5OH + N2 + H2O
Amin thơm bậc I: tác dụng với HNO2 phản ứng ở nhiệt độ thấp (0-5 độcC) tạo thành muối diazoni
Phương trình: C6H5NH2 + HONO + HCl -> C6H5N2 + Cl- + 2H2O
Amin bậc II: tạo hợp chất Nitrozamin có hiện tượng màu vàng.
Amin bậc III: vì không còn liên kết H nữa => không phản ứng.
* Phản ứng ankyl hóa:
Amin bậc I hoặc bậc II tác dụng với ankyl halogenua (CH3l,…) nguyên tử H của nhóm amin có thể bị thay thế bởi gốc ankyl:
Phương trình: C2H5NH2 + CH3I → C2H5NHCH3 + HI. Dùng để điều chế amin bậc cao từ các amin bậc thấp hơn.
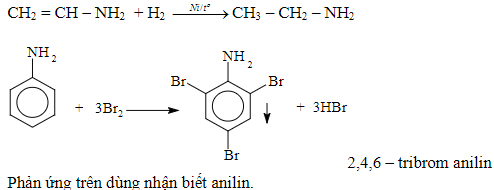
* Phản ứng thế vào nhân thơm của Anilin:
Anilin tác dụng với nước Brom tạo thành kết tủa trắng 2, 4, 6 – tribromanilin
* Phản ứng cháy của amin no đơn chức mạch hở:
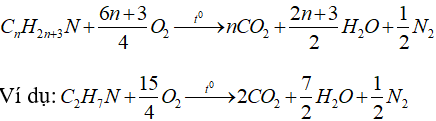
6. Ứng dụng và điều chế Amin:
* Ứng dụng của Amin:
Các amin được dùng trong tổng hợp hữu cơ, tạo ra các sản phẩm có ứng dụng làm tơ, phẩm nhuộm, dược phẩm, đặc biệt là các điamin được dùng để tổng hợp polime.
Dimetylamin ứng dụng dùng để sản xuất dung môi.
Phương trình: 2C2H6NH + CS2 → [C2H6NH2] + [C2H6NCS2]- Dimetyldithiocacbamat
Amphetamine tăng huyết áp và mạch nhưng gây nghiện. Chloropheniramine thuộc một trong những thành phần trong thuốc trị cảm cúm. Chlorodiazeppoxide có tác dụng an thần. Novocain và demerol được dùng như thuốc gây mê và giảm đau.
Dimetyl amin là tiền chất cho một vài hợp chất có tầm quan trọng trong công nghiệp .Vũ khí hóa học C5H11N2O2P có nguồn gốc từ dimetyl amin.
Anilin dùng để sản xuất polime, sản xuất chất dẻo ( anilin-fomanđehit,…).
Các loại thức ăn giàu protein khi chiên, rán, nướng ở nhiệt độ cao sẽ tạo ra các amin dị vòng.
* Điều chế Amin:
Thay thế nguyên tử H của phân tử amoniac: NH3 + RI → R – NH2 + HI
Phương trình:![]()
Khử hợp chất nitro:
Phương trình:![]()
Dùng kiềm mạnh đẩy amin ra khỏi muối amoni:
Phương trình: C6H5NH3Cl + NaOH → C6H5NH2 + NaCl + H2O. Dùng để tách anilin ra khỏi hỗn hợp.
7. Một số bài tập vận dụng có liên quan đến Amin:
Bài tập 1: Tại sao amin có tính bazơ? Chọn đáp án đúng:
A. Amin có khả năng nhường proton.
B. Trên nitơ còn có một đôi electron tự do có khả năng nhận H+.
C. Xuất phát từ amoniac.
D. Amin phản ứng được với dung dịch axit nitro HNO2.
Hướng dẫn giải:
Amin có tính axit là do trên Nitơ còn có một đôi electron tự do có khả năng nhận H+
Kết luận: Đáp án B.
Bài tập 2: Cho ba chất lỏng: benzen, anilin, stiren đựng riêng biệt trong ba lọ mất nhãn. Ta dùng thuốc thử nào sau đây để nhận biết ba chất lỏng trên:
A. Nước brom
B. Giấy quỳ tím
C. Dung dịch phenolphtalein
D. Dung dịch NaOH
Hướng dẫn giải:
Sử dụng nước brom tác dụng với ba lọ mất nhãn trên:
– Lọ dung dịch nào làm mất màu nước brom là stiren:
Phương trình: C6H5 – CH = CH2 + Br2 → C6H5 – CHBr – CH2Br
– Lọ dung dịch nào tạo kết tủa trắng là anilin:
Phương trình: C6H5-NH2 + 3Br2 → C6H2(Br)3-NH2↓ + 3HBr
– Lọ dung dịch nào không có hiện tượng gì là benzen.
Kết luận: Đáp án A.
Bài tập 3: Sử dụng 10 gam amin đơn chức Z phản ứng hoàn toàn với HCl (dư), kết quả thu được 15 gam muối. Vậy số đồng phân cấu tạo của Z là bao nhiêu?
A. 5.
B. 8.
C. 7.
D. 4.
Hướng dẫn giải:
Áp dụng định luật bảo toàn khối lượng ta có: m HCl phản ứng = m muối – m Z
=> m HCl = 15 – 10 = 5 gam
=> n HCl = 5/36,5 (mol)
Ta có : n Z = n HCl = 5/36,5 ( Z là amin đơn chức => sẽ phản ứng với HCl theo tỉ lệ 1:1 )
=> M Z = 10 : 5 /36,5 = 73 (gam/mol) => Z là : C4H11N
Số các đồng phân của Z là:
– Amin bậc I, ta có: CH3-CH2-CH2-CH2-NH2
CH3-CH2-CH(NH2)-CH3
CH3-CH(CH3)-CH2-NH2
(CH3)2-C(NH2)-CH3
– Amin bậc II, ta có:
CH3-NH-CH2-CH2-CH3
CH3-NH-CH(CH3)-CH3
CH3-CH2-NH-CH2-CH3
– Amin bậc III, ta có:
(CH3)2N-CH2-CH3
Kết luận: Đáp án B.
Bài tập 4: Cho 21,9 gam amin đơn chức X phản ứng hoàn toàn với dung dịch FeCl3 (dư), thu được 10,7 gam kết tủa. Vậy số đồng phân cấu tạo bậc I của X là :
A. 5.
B. 8.
C. 7.
D. 4.
Hướng dẫn giải:
Theo giả thiết ta có phương trình phản ứng:
3RNH2 + Fe3+ + H2O → 3[RNH3]+ + Fe(OH)3
Ta có: n Fe(OH)3 = 10,7 : 107 = 0,1 (mol), n Amin = 3 n Fe(OH)3 = 0,3 mol
=> Khối lượng mol của amin là: 21,9 : 0,3 = 73 gam/mol
=> X là : C4H9NH2
Vậy số đồng phân cấu tạo bậc I của X là:
CH3-CH2-CH2-CH2-NH2
CH3-CH2-CH(NH2)-CH3
CH3-CH(CH3)-CH2-NH2
CH3-C(CH3)(NH2)-CH3
Kết luận: Đáp án D.
Bài tập 5: Cho hỗn hợp 1,07g hai amin đơn chức bậc I kế tiếp nhau trong dãy đồng đẳng phản ứng với axit nitro ở nhiệt độ thường kết quả tạo ra dung dịch X. Cho dung dịch X tác dụng với Na dư thu được 0,03 mol H2. Hãy xác định công thức hai amin?
A. C3H7NH2 và C4H9NH2
B. C2H5NH2 và C3H7NH2
C. CH3NH2 và C2H5NH2
D. CH3NH2 và C3H7NH2
Hướng dẫn giải:
Ta đặt công thức chung của hai amin là: R−NH2
Ta có phương trình phản ứng: R−NH2 + HONO → R−OH + N2 + H2O
Dung dịch X gồm R−OH và H2O phản ứng với Na, ta có: nR−OH + nH2O = 2nH2 = 0,06
=> Ta có: n R−OH = nH2O = 0,03 mol = n R−NH2
=>R−OH = 1,07: 0,03 = 35,6
=> R− = 18,6
=> -CH3 (=15) và -C2H5 (=29)
Kết luận: Đáp án C.
Bài tập 6: Khi đốt cháy hoàn toàn hỗn hợp hai amin no, đơn chức, là đồng đẳng liên tiếp, thu được 2,24 lít khí CO2 ( điều kiện tiêu chuẩn ) và 3,6 gam H2O. Hãy viết công thức phân tử của hai amin?
A. CH5N và C2H7N.
B. C2H7N và C3H9N.
C. C3H9N và C4H11N.
D. Kết quả khác.
Hướng dẫn giải:
Ta có: n H2O = 3,6 : 18 = 0,2 (mol)
n CO2 = 2,24 : 22,4 = 0,1 (mol)
=> Số mol của hỗn hợp amin sẽ là: (0,2 – 0,1) : 1,5 = 0,2/3 (mol)
Số nguyên tử cacbon trung bình có trong hỗn hợp amin là: n CO2 : n Amin = 0,1 : 0,2/3 = 1,5
Theo giả thiết hai amin thuộc dãy đồng đẳng liên tiếp => Công thức của 2 amin là CH5N và C2H7N
Kết luận: Đáp án A.




