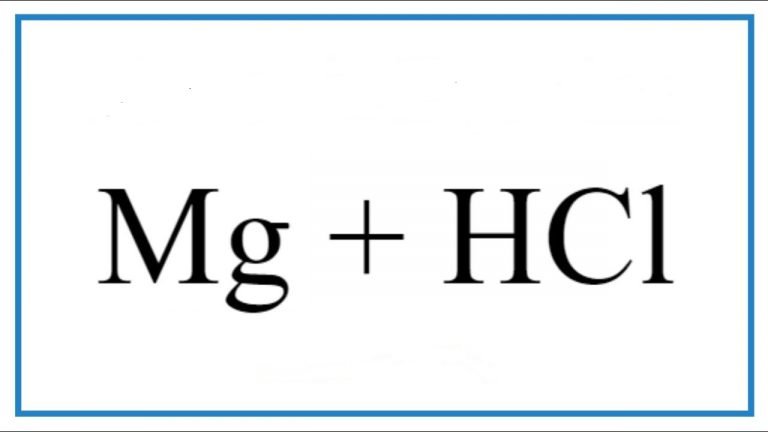Bài viết dưới đây chúng minh các bạn phương trình FeO + HNO3 → Fe(NO3)3 + NO2 + H2O được biên soạn hoàn thành gửi tới các bạn. Hy vọng tài liệu giúp các bạn biết cách viết và cân bằng phương trình phản ứng, hiện tượng sau phản ứng khi cho Fe tác dụng với HNO3 loãng dư.
Mục lục bài viết
1. Phương trình phản ứng giữa FeO tác dụng HNO3 đặc nóng:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
2. Hướng dẫn cân bằng phản ứng FeO + HNO3 → Fe(NO3)3 + NO2 + H2O:
Fe+2O + HN+5O3 → Fe+3(NO3)3 + N+4O2 + H2O
Dùng thăng bằng electron
| 1 x 1 x | Fe+2 → Fe3++ 1e
N+5 + 1e → N+4 | |
Vậy phương trình ta có:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
3. Điều kiện phản ứng FeO HNO3 đặc nóng:
HNO3 đặc nóng
4. Tính chất của sắt (II) oxit FeO:
4.1. Tính chất vật lí:
FeO là một chất rắn màu đen, không có trong tự nhiên.
Không tan trong nước.
4.2. Tính chất hóa học:
Các hợp chất sắt (II) có cả tính khử và tính oxi hóa nhưng tính khử đặc trưng hơn, do trong các phản ứng hóa học ion Fe2+ dễ nhường 1e thành ion Fe3+
Fe2+ + 1e → Fe3+
Tính chất đặc trưng của hợp chất sắt (II) là tính khử.
Các hợp chất sắt (II) thường kém bền dễ bị oxi hóa thành hợp chất sắt (III).
FeO là 1 oxit bazơ, ngoài ra, do có số oxi hóa +2 – số oxi hóa trung gian => FeO có tính khử và tính oxi hóa.
FeO là 1 oxit bazơ:
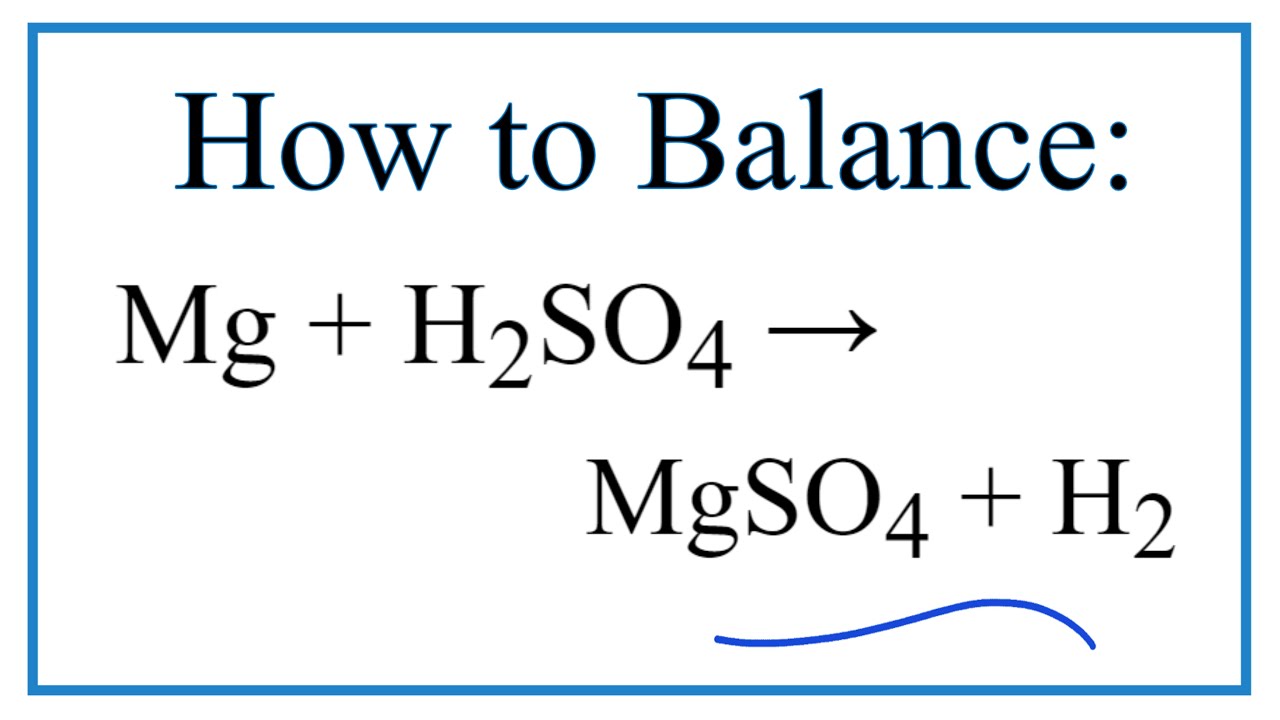
+ Tác dụng với dung dịch axit: HCl; H2SO4 loãng…
FeO + 2HCl → FeCl2 + H2
FeO + H2SO4 loãng→ FeSO4 + H2O
FeO là chất oxi hóa khi tác dụng với các chất khử mạnh: H2, CO, Al → Fe:
FeO + H2
Fe + H2O
FeO + CO
Fe + CO2
3FeO + 2Al
Al2O3 + 3Fe
FeO là chất khử khi tác dụng với các chất có tính oxi hóa mạnh: HNO3; H2SO4 đặc; O2…
4FeO + O2
2Fe2O3
3FeO + 10HNO3 loãng→ 3Fe(NO3)3 + NO + 5H2O
FeO + 4HNO3 đặc,nóng → Fe(NO3)3 + NO2 + 2H2O
2FeO + 4H2SO4 đặc, nóng → Fe2(SO4)3 + SO2 + 4H2O
5. Bài tập vận dụng liên quan:
Câu 1. Dãy các chất nào sau đây tác dụng với HNO3 đặc nóng đều xảy ra phản ứng oxi hóa khử là
A. Fe, FeO, Fe(OH)2, Fe(OH)3
B. Fe, FeO, Fe(NO3)2, FeCO3
C. Fe, FeSO4, Fe2(SO4)3, FeCO3
D. Fe, FeO, Fe(NO3)2, Fe(NO3)3
Câu 2. Hòa tan hỗn hợp ba kim loại gồm Zn, Fe, Cu bằng dung dịch HNO3 loãng. Sau khi phản ứng xảy ra hoàn toàn, thu được chất rắn không tan là Cu. Dung dịch sau phản ứng chứa
A. Zn(NO3)2 và Fe(NO3)3.
B. Zn(NO3)2; Fe(NO3)2 và Cu(NO3)2.
C. Zn(NO3)2 và Fe(NO3)2.
D. Zn(NO3)2; Fe(NO3)3 và Cu(NO3)2.
Câu 3. Cách nào sau đây có thể dùng để điều chế FeO?
A. Dùng CO khử Fe2O3 ở 500°C.
B. Nhiệt phân Fe(OH)2 trong không khí.
C. Nhiệt phân Fe(NO3)2
D. Đốt cháy FeS trong oxi.
Câu 4. Hòa tan hoàn toàn 2,8 gam hỗn hợp FeO, Fe2O3 và Fe3O4 cần vừa đủ V ml dung dịch HCl 1M , thu được dung dịch X. Cho từ từ dung dịch NaOH dư vào dung dịch X thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi thu được 3 gam chất rắn. Tính V ?
A. 87,5ml
B. 125ml
C. 62,5ml
D. 175ml
Câu 5. Dung dịch FeSO4 không làm mất màu dung dịch nào sau đây ?
A. Dung dịch KMnO4 trong môi trường H2SO4
B. Dung dịch K2Cr2O7 trong môi trường H2SO4
C. Dung dịch Br2
D. Dung dịch CuCl2
Câu 6. Cho 5,4 gam hỗn hợp 2 kim loại Fe và Zn tác dụng hoàn toàn với 90 ml dung dịch HCl 2M. Khối lượng muối thu được là
A. 11,79 gam
B. 11,5 gam
C. 15,71 gam
D. 17,19 gam
Câu 7. Dung dịch loãng chứa hỗn hợp 0,01 mol Fe(NO3)3 và 0,15 mol HCl có khả năng hòa tan tối đa lượng Fe là:
A. 0,28 gam
B. 1,68 gam
C. 4,20 gam
D. 3,64 gam
Câu 8. Phản ứng nào sau đây không tạo ra muối sắt (III)?
A. Fe2O3 tác dụng với dung dịch HCl đặc
B. Fe(OH)3 tác dụng với dung dịch H2SO4
C. Fe dư tác dụng với dung dịch HNO3 đặc nguội
D. FeO tác dụng với dung dịch HNO3 loãng (dư).
Câu 9. Thổi hỗn hợp khí CO và H2 đi qua x gam hỗn hợp gồm CuO và Fe3O4 có tỉ lệ mol 1:2, sau phản ứng thu được y gam chất rắn X. Hòa tan hoàn toàn b gam X bằng dung dịch HNO3 loãng dư, thu được dung dịch Y (không chứa ion Fe2+). Cô cạn dung dịch Y thu được 41 gam muối khan. Giá trị của a là
A .13,6
B. 10,6.
C. 12,8.
D. 9,8.
Câu 10. Hòa tan hỗn hợp gồm Fe và Cu vào dung dịch HNO3 loãng, sau phản ứng thu được chất rắn và dung dịch. Vậy trong dung dịch có các muối là:
A. Cu(NO3)2
B. Fe(NO3)2, Cu(NO3)2
C. Fe(NO3)3, Cu(NO3)2
D. Cu(NO3)2, Fe(NO3)2, HNO3
Câu 11. Cho m gam hỗn hợp X gồm Fe, FeO vào dung dịch H2SO4 loãng (dư), sau khi kết thúc phản ứng sinh ra 2,24 lít khí (đktc). Nếu cho hỗn hợp X ở trên vào một lượng dư axit nitric (đặc, nguội), sau khi kết thúc phản ứng sinh ra 3,36 lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của m là
32
Câu 12. Thêm bột sắt (dư) vào các dung dịch riêng biệt sau: FeCl3, AlCl3, CuSO4, Pb(NO3)2, NaCl, HCl, HNO3(loãng), H2SO4 (đặc nóng). Sau khi các phản ứng xảy ra hoàn toàn, số trường hợp phản ứng tạo ra muối Fe(II) là
A. 4
B. 5
C. 6
D. 7
Câu 13. Nhỏ từ từ đến dư dung dịch FeSO4 đã được axit hóa bằng H2SO4 vào dung dịch KMnO4. Hiện tượng quan sát được là
A. dung dịch màu tím hồng bị nhạt dần rồi chuyển sang màu vàng
B. dung dịch màu tím hồng bị nhạt dần đến không màu
C. dung dịch màu tím hồng bị chuyển dần sang nâu đỏ
D. màu tím bị mất ngay. Sau đó dần dần xuất hiện trở lại thành dung dịch có màu hồng
6. Các cách học tốt môn hóa:
6.1. Cách học tốt lý thuyết môn hóa:
– Để học tốt môn hóa học các em cần nắm lý thuyết về các khái niệm, định nghĩa, định luật hay quy định đã được quy định trong chương trình. Ngoài ra, các em cần quan sát các thí nghiệm, hiện tượng trong tự nhiên, trong đời sống… vì lý thuyết hóa học rất sát với thực tế. Và dần dần bạn sẽ tích lũy được kiến thức.
– Xử lý thông tin: tự mình làm, trải nghiệm để rút ra kết luận hoặc rút ra nhận xét quan trọng cho bản thân.
– Vận dụng kiến thức đã học để trả lời các câu hỏi hoặc làm bài tập, áp dụng vào thực tế để hiểu sâu bài học (đó là cách lý tưởng để học hóa học).
– Để học tốt môn hóa phải biết cách học và ghi nhớ có chọn lọc, logic: môn hóa học vẹt rất khó nhớ, học thuộc lòng.
6.2. Cách làm tốt bài tập môn hóa:
a. Bài tập về các chất:
– Tên: bao gồm cách gọi chất (một chất có thể có nhiều tên: tên thông thường, tên quốc tế).
– Lý tính: thông thường chúng ta chú ý ghi nhớ trạng thái (rắn, nhỏ giọt, khí), màu sắc, độ tan, mùi, vị, độ tăng nhiệt độ, nhiệt độ nóng chảy,…
– Cấu tạo: được gọi là cấu hình đã biết của mỗi loại, liên kết trong phân tử của nó. Viết công thức cấu tạo của từng loại hợp chất.
– Hoá học:
+ Dựa vào đặc điểm cấu tạo để suy ra tính chất cơ bản. Từ hóa tính chất của chất tiêu biểu, suy nghĩ khái quát hóa tính chất cho loại hợp chất đó.
+ Với các chất điển hình, khi học hóa học chúng ta cần thuộc kỹ năng thuộc loại chất nào, chọn loại chất nào phản ứng, tác dụng với chất nào thì mới có thể nhớ và học tốt hóa học. hơn.
– Điều chế:
+ Nắm được phương pháp điều khiển chung của các hợp chất. Đối với mỗi loại hợp chất cụ thể, ngoài các phương pháp chung còn có các phương pháp điều chế riêng.
+ Phải nhớ tên nguyên liệu điều chế các chất.
Ứng dụng : ghi nhớ ứng dụng của từng hợp chất, liên hệ cuộc sống.
b. Cách làm tốt bài tập hóa học:
*Các bài tập áp dụng :
Để học tốt môn hóa học, học sinh cần bám sát kiến thức hóa học – điều chế, kết hợp với cấu tạo và lập luận, chú ý đến các hiện tượng hóa học xảy ra.
– Viết phương trình phản ứng: phải nắm phần hóa học của các chất, suy nghĩ xem loại hợp chất nào phản ứng được với chất nào?
– Chuỗi phản ứng: Nắm tính chất hóa học và điều chế, mối quan hệ giữa các chất, sự biến đổi mạch cacbon,… kết hợp với điều kiện phản ứng để suy luận và tìm công thức của các chất (đối với dạng khó), Học thuộc lòng các cân bằng và xác định điều kiện nếu có.
– Nhận biết hoá chất: biết thuốc thử cần dùng, kí hiệu và viết phương trình phản ứng kí hiệu.
– Giải thích hiện tượng, chứng minh: viết phản ứng xảy ra ở từng giai đoạn, lưu ý hiện tượng tạo ra kết cấu – bay hơi hay sự biến đổi màu, mùi,…
*Bí quyết làm bài thi môn hóa :
Muốn học tốt môn hóa và làm bài thi môn hóa đạt điểm cao, cần chăm chỉ học lý thuyết, có kỹ năng tính toán (vận dụng công thức, tính toán bằng phương pháp phản ứng, lập và giải hệ phương trình),…).
– Nêu điều kiện của bài toán (số liệu, mối quan hệ giữa các chất phản ứng, điều kiện để xảy ra phản ứng,…) yêu cầu của bài toán.
– Đặt ẩn số (thường là số mol, đặt công thức chung)
– Viết tất cả các phương pháp phản ứng ra. (nên sắp xếp theo thứ tự, nhớ cân đối, ghi điều kiện nếu có)
– Xác lập mối quan hệ giữa dữ liệu của bài toán với yêu cầu của bài toán, lập hệ phương trình toán học,…
– Sử dụng các thủ thuật tính toán (phương pháp trung bình cộng, đặt ẩn,…) vận dụng các định luật hóa học cơ bản (định luật bảo toàn khối lượng, định luật bảo toàn điện tích,…) để giải các bài toán.