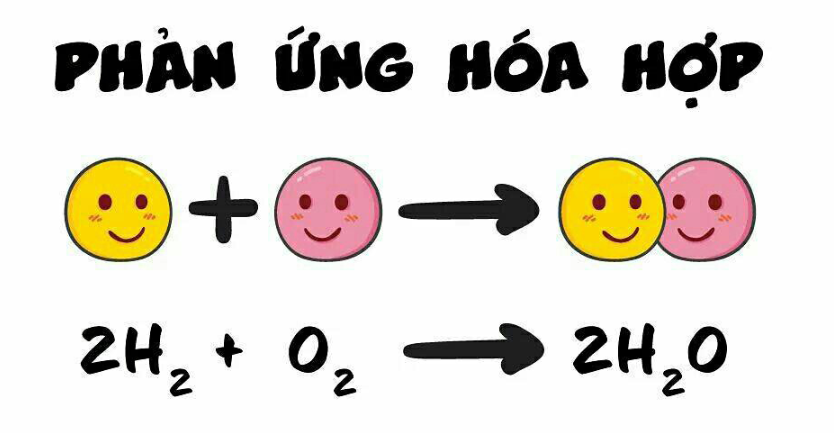Phương trình hóa học CO + O2 → CO2 mô tả quá trình cháy hoàn toàn của khí carbon monoxide (CO) trong môi trường có khí oxi (O2), tạo ra khí carbon dioxide (CO2). Dưới đây là một số ứng dụng và chi tiết về phương trình này, mời bạn đọc theo dõi.
Mục lục bài viết
1. Thông tin về các chất trong phương trình hóa học CO + O2 → CO2:
1.1. CO là chất gì?
CO là công thức hóa học cho khí carbon monoxide. Đây là một chất hóa học quan trọng nhưng độc hại.
Thông tin chi tiết về carbon monoxide (CO):
– Cấu trúc và tính chất: CO là một phân tử gồm một nguyên tử carbon (C) kết hợp với một nguyên tử oxi (O). Nó có công thức hóa học là CO. Mạch hở của CO là C=O, trong đó liên kết giữa C và O là liên kết ba ba.
CO là một khí không màu, không mùi và không vị, nghĩa là nó không thể được phát hiện dễ dàng bằng các giác quan thông thường. Điều này làm tăng nguy cơ gây ngộ độc CO nếu không được nhận ra kịp thời.
– Sản xuất: CO có thể được tạo ra trong nhiều quá trình công nghiệp, bao gồm đốt cháy không hoàn toàn các nguyên liệu carbon như than đá, dầu mỏ và khí tự nhiên. Nó cũng có thể được sản xuất trong các quá trình công nghiệp khác như sản xuất sắt thép, chế tạo hóa chất và sản xuất hợp chất hữu cơ.
– Độc tính: Carbon monoxide là một chất độc, nguyên nhân chính của nó là khả năng tạo thành liên kết mạnh với hemoglobin trong máu. Khi hít thở khí chứa CO, nó sẽ kết hợp với hemoglobin và hình thành carboxyhemoglobin, gây cản trở khả năng chuyển oxy của máu. Điều này có thể dẫn đến tình trạng thiếu oxy trong cơ thể, gây ra các triệu chứng từ nhẹ như đau đầu, buồn nôn đến nghiêm trọng như thương tâm và tử vong.
– Nguy cơ và an toàn: CO thường xuất hiện trong các môi trường có đốt cháy không hoàn toàn, như trong xe ô tô, lò sưởi, lò nấu và lò sưởi. Vì CO không có mùi, người ta thường sử dụng cảm biến CO để phát hiện sự hiện diện của nó. Khi phát hiện CO trong không khí, cần thoát khỏi khu vực bị ô nhiễm ngay lập tức và thông báo cho cơ quan chức năng để xử lý tình huống.
– Ứng dụng: Mặc dù CO là chất độc, nó cũng có nhiều ứng dụng công nghiệp. Nó được sử dụng trong quá trình sản xuất thép, chế tạo hóa chất, sản xuất hợp chất hữu cơ, và làm chất khử kim loại trong quá trình luyện kim. Ngoài ra, CO cũng được sử dụng trong các quá trình công nghệ hóa dầu, tổng hợp methanol và tổng hợp các sản phẩm hữu cơ khác.
Tuy nhiên, do tính độc hại và nguy hiểm của CO, việc sử dụng và tiếp xúc với nó phải được thực hiện trong điều kiện an toàn và kiểm soát chặt chẽ để tránh nguy cơ ngộ độc.
1.2. O2 là chất gì?
O2 là công thức hóa học cho khí oxi, còn được gọi là dioxit oxi. Đây là một chất không màu, không mùi và không vị. O2 là một trong những chất quan trọng nhất trên Trái Đất vì vai trò quan trọng của nó trong quá trình hô hấp và sự sống.
Thông tin chi tiết về khí oxi (O2):
– Cấu trúc và tính chất: O2 là phân tử được tạo thành từ hai nguyên tử oxi (O) liên kết với nhau. Công thức hóa học của O2 là O=O, trong đó liên kết giữa hai nguyên tử oxi là liên kết đôi.
O2 là một khí không màu, không mùi và không vị. Nó không độc hại cho con người và thường tồn tại dưới dạng khí trong điều kiện thông thường.
– Sản xuất: O2 có thể được sản xuất thông qua quá trình như phân ly nước (electrolysis) hoặc từ các quá trình công nghiệp như quá trình luyện kim như nấu nhôm, sản xuất axit nitric và trong quá trình chế tạo hóa chất. O2 cũng là một phần không thể thiếu trong quá trình quang hợp của thực vật, nơi nó được tạo ra từ quang hợp nước.
– Vai trò và ứng dụng: O2 đóng vai trò quan trọng trong quá trình hô hấp của sinh vật, cung cấp oxy cho việc đốt cháy và tạo năng lượng. Nó là yếu tố cần thiết để duy trì sự sống của các hệ sinh thái và hỗ trợ các quá trình sinh học quan trọng.
Ngoài ra, O2 cũng được sử dụng trong các ứng dụng công nghiệp, y tế và hóa học. Nó có thể được sử dụng để tăng hiệu suất đốt cháy trong các quá trình công nghiệp, oxy hóa hợp chất hữu cơ, và làm tăng áp suất trong các bình khí. O2 cũng được sử dụng trong ngành y tế để cung cấp oxy cho những người có vấn đề hô hấp và trong các quá trình hồi sức.
2. Cân bằng phương trình hóa học CO + O2 → CO2:
Phương trình hóa học đã cho là:
CO + O2 → CO2
Để cân bằng phương trình này, ta cần đảm bảo số lượng nguyên tử của mỗi nguyên tố trên cả hai bên của phương trình là bằng nhau.
Để cân bằng số lượng nguyên tử carbon (O), ta thấy bên phải có 3 nguyên tử (O) và bên trái 2 nguyên tử (O) để cân bằng ta thêm như sau
2CO + O2 → 2CO2
Vậy phương trình cân bằng là:
2CO + O2 → 2CO2
3. Ứng dụng của phương trình hóa học CO + O2 → CO2:
Phương trình hóa học CO + O2 → CO2 mô tả quá trình cháy hoàn toàn của khí carbon monoxide (CO) trong môi trường có khí oxi (O2), tạo ra khí carbon dioxide (CO2). Dưới đây là một số ứng dụng và chi tiết về phương trình này:
– Quá trình đốt cháy: Phương trình CO + O2 → CO2 là phản ứng cháy hoàn toàn của khí carbon monoxide. Trong quá trình này, CO kết hợp với khí oxi để tạo ra CO2. Đây là một trong những ứng dụng chính của phương trình này, trong đó CO được đốt cháy hoàn toàn để tạo ra CO2, giải phóng năng lượng.
– Lò nấu và lò sưởi: Phương trình này liên quan đến quá trình đốt cháy carbon monoxide trong các lò nấu và lò sưởi. CO thường tồn tại trong các hệ thống đốt cháy không hoàn toàn như lò sưởi, bếp ga và lò nấu. Việc đốt cháy CO để tạo ra CO2 là quan trọng để giảm thiểu nguy cơ gây ngộ độc CO và đảm bảo an toàn trong môi trường sống và làm việc.
– Môi trường: Quá trình đốt cháy CO thành CO2 có vai trò quan trọng trong việc giảm thiểu khí thải gây ô nhiễm. CO là một khí thải độc hại và có khả năng gây hại đến môi trường và sức khỏe con người. Bằng cách đốt cháy CO để tạo ra CO2, quá trình này giúp giảm thiểu lượng CO trong không khí và giảm tác động tiêu cực đến môi trường.
– Nghiên cứu và phân tích: Phương trình CO + O2 → CO2 cũng được sử dụng trong nghiên cứu và phân tích. Quá trình cháy CO thành CO2 được sử dụng trong các phương pháp đo lường, kiểm tra và phân tích để xác định nồng độ CO trong các mẫu khí hoặc trong quá trình quan sát các quá trình liên quan đến CO.
Tóm lại, phương trình hóa học CO + O2 → CO2 mô tả quá trình cháy hoàn toàn của carbon monoxide (CO) trong môi trường có oxi (O2). Nó có ứng dụng quan trọng trong quá trình cháy, lò nấu và lò sưởi, bảo vệ môi trường, cũng như trong các nghiên cứu và phân tích liên quan đến khí CO.
4. Bài tập liên quan đến phương trình hóa học CO + O2 → CO2:
Câu 1. Dãy chất nào sau đây đều tác dụng với khí oxi?
A. C2H4, Ag, Al, Fe, CuO.
B. BaCO3, K, Na, Cu, S.
C. C2H4, Na, Al, Fe, S.
D. C2H6O, Mg, CO2, P, CH4.
Lời giải:
Đáp án: C
Câu 2. Trong các chất sau: BaO, Mn2O7, P2O5, CO, Fe2O3, SiO2, CuO, H2S, NH3. Dãy gồm các oxit bazơ là
A. CO, Fe2O3, SiO2.
B. BaO, Mn2O7, H2S.
C. Fe2O3, SiO2, NH3.
D. BaO, Fe2O3, CuO.
Lời giải:
Đáp án: D
Câu 3. Những nhận định nào dưới đây không đúng về khí oxy?
(1) Oxy tồn tại ở thể khí ở điều kiện nhiệt độ phòng.
(2) Khí oxy tan nhiều trong nước.
(3) Khí oxy duy trì sự sống và sự cháy.
(4) Trong không khí, oxy chiếm 78% về thể tích.
(5) Khí oxy không màu, không mùi, không vị.
(6) Thu khí oxy trong phòng thí nghiệm bằng cách đẩy không khí
A. (1), (2), (6)
B. (2), (4),
C. (3), (4), (5)
D. (1), (5)
Lời giải:
Đáp án: B
Câu 4. Nhận định đúng về tính chất vật lí của cacbon oxit là
A. chất khí nặng hơn không khí.
B. chất khí không màu, không mùi, rất độc.
C. chất khí tan nhiều trong nước.
D. chất lỏng ở điều kiện thường.
Lời giải:
Đáp án: B
Câu 5. Nhận định nào sau đây sai?
A. Cacbon monoxit không tạo ra muối và là một chất khử mạnh.
B. Ở nhiệt độ cao cacbon có thể khử được tất cả các oxit kim loại giải phóng kim loại.
C. than gỗ được dùng để chế thuốc súng, thuốc pháo, chất hấp phụ.
D. than muội được dùng để làm chất độn cao su, sản xuất mực in, xi đánh giầy.
Lời giải:
Đáp án: B
Câu 6. CO khử được oxit kim loại nào sau đây?
A. Al2O3.
B. BaO.
C. Fe2O3.
D. MgO.
Lời giải:
Đáp án: C
Câu 7. Ở nhiệt độ cao, khí CO khử được các oxit nào sau đây
A. Fe2O3 và CuO
B. Al2O3 và CuO
C. MgO và Fe2O3
D. CaO và MgO.
Lời giải:
Đáp án: A
Câu 8: Cho những phương trình hóa học sau đây:
C+O2→CO2
CH4+2O2→CO2+2H2O
N2+O2→NO
CaCO3→CaO+CO2
H2+I2→HI
Fe+HCI→FeCl2+H2
CO2+C→CO
a. Phương trình hóa học nào trên đây đã cân bằng?
b. Cân bằng các phương trình chưa cân bằng.
Đáp án:
a. C+O2→CO2
CH4+2O2→CO2+2H2O
CaCO3→CaO+CO2
b. N2+O2→2NO
H2+I2→2HI
Fe+HCI→FeCl2+H2
CO2+C→2CO