CH4 + O2 → CO2 + H2O được biên soạn hướng dẫn các bạn viết và cân bằng đúng phương trình cháy của metan tạo ra khí cacbonic và nước. Cũng như đưa ra các nội dung lý thuyết, câu hỏi liên quan đến tính chất hóa học của metan. Mời các bạn xem chi tiết phương trình phản ứng dưới đây.
Mục lục bài viết
1. Phương trình phản ứng hóa học:
CH4 + O2 → CO2 + H2O
2. Phân tích Phương trình phản ứng hóa học CH4 + O2 → CO2 + H2O:
2.1. Điều kiện phản ứng đốt cháy metan xảy ra:
Điều kiện phản ứng: nhiệt độ
2.2. Cách thực hiện phản ứng:
Đốt cháy hoàn toàn khí metan CH4 trong không khí thì thu được khí cacbonic và nước.
2.3. Hiện tượng nhận biết phản ứng:
Dẫn sản phẩm cháy đi qua bình đựng nước vôi trong dư thấy có kết tủa trắng xuất hiện
2.4. Bạn có biết:
‐ Phản ứng trên được gọi là phản ứng đốt cháy.
‐ Tương tự metan (CH4) các đồng đẳng của metan cũng tham gia phản ứng đốt cháy tương tự.
‐ Nếu thiếu oxi, phản ứng cháy của ankan xảy ra không hoàn toàn: sản phẩm cháy ngoài CO2, H2O còn có C, CO…
‐ Khi đốt cháy ankan, số mol H2O thu được sau phản ứng luôn lớn hơn số mol CO2.
3. Bài tập vận dụng liên quan:
Câu 1: Phản ứng hóa học đặc trưng của metan là:
A. Phản ứng thế
B. Phản ứng cộng
C. Phản ứng oxi hóa – khử
D. Phản ứng phân hủy
Câu 2: Các tính chất vật lí cơ bản của metan là:
A. Chất khí, không màu, tan nhiều trong nước.
B. Chất khí, không màu, không mùi, nhẹ hơn không khí, tan ít trong nước.
C. Chất khí không màu, tan nhiều trong nước.
D. Chất khí không màu, không mùi, nặng hơn không khí, tan ít trong nước.
Câu 3: Trong phòng thí nghiệm có thể thu được khí CH4 bằng cách:
A. Đẩy không khí (ngửa bình)
B. Đẩy axit
C. Đẩy nước (úp bình)
D. Đẩy bazo
Câu 4: Để chứng minh sản phẩm của phản ứng cháy giữa metan và oxi có tạo thành khí cacbonic hay không ta cho vào ống nghiệm hóa chất nào sau đây?
A. Nước cất
B. Nước vôi trong
C. Nước muối
D. Thuốc tím
Câu 5: Điều kiện để phản ứng giữa Metan và Clo xảy ra là
A. Có bột sắt làm xúc tác
B. Có axit làm xúc tác
C. Có nhiệt độ
D. Có ánh sáng
Câu 6: Những phát biểu nào sau đây không đúng?
1) Metan tác dụng với Clo khi có ánh sáng.
2) Metan là chất khí, không màu, không mùi, nặng hơn không khí.
3) Metan cháy nhiều nhiệt nên được sử dụng làm nhiên liệu trong đời sống và sản xuất.
4) Hỗn hợp giữa metan và Clo là Hỗn hợp nổ.
5) Trong phân tử metan có 4 liên kết đơn -CH.
6) Metan tác dụng với Clo ở điều kiện thường.
A. 1, 3, 5.
B. 1, 2, 6.
C. 2, 4, 6.
D. 2, 4, 5
Câu 7: Trong các phương trình hóa học sau, phương trình hóa học nào viết đúng? Phương trình hóa học nào viết sai?
A. CH4 + Cl2 → CH2Cl2 + H2 (ánh sáng)
B. CH4 + Cl2 → CH2 + 2HCl (ánh sáng)
C. 2CH4 + Cl2 → 2CH3Cl + H2 (ánh sáng)
D. CH4 + Cl2 → CH3Cl + HCl (ánh sáng)
Câu 8: Đốt cháy hoàn toàn 11,2 lít khí metan (đktc). Hãy tính thể tích khí Oxi cần dùng và thể tích khí cacbonic tạo thành. Biết thể tích các khí đó ở đktc.
Câu 9: Có một hỗn hợp khí gồm CH4 và CO2. Hãy trình bày phương pháp hóa học để
a) Thu được khí CH4.
b) Thu được khí CO2.
4. Hướng dẫn lời giải:
Câu 1:
Đáp án: A. Phản ứng thế.
Câu 2:
Đáp án: B.
Các tính chất vật lí của cơ bản của metan là chất khí, không màu, không mùi, nhẹ hơn không khí, tan ít trong nước.
Câu 3:
Đáp án: C. Đẩy nước (úp bình)
Câu 4:
Đáp án: B. Nước vôi trong
Câu 5:
Đáp án: D. Có ánh sáng
Câu 6:
Đáp án: C. 2,4,6
Các phát biểu không đúng là 2,4,6.
2) Metan là chất khí, không màu, không mùi, nặng hơn không khí →-Sai: khí metan nhẹ hơn không khí.
4) Hỗn hợp giữa metan và clo là Hỗn hợp nổ →-Sai
6) Metan tác dụng với Clo ở điều kiện thường. →-Sai, phải có chiếu sáng thì phản ứng mới xảy ra.
Câu 7:
Đáp án: D. CH4 + Cl2 → CH3Cl + HCl (ánh sáng)
Phương trình hóa học D là đúng. Còn các phương trình còn lại đều sai.
Câu 8:
nCH4 = 11,2/22,4 = 0,5 mol
Phương trình phản ứng:
CH4 + 2O2 → CO2 + 2H2O
Theo phương trình: nO2 = 2 x nCH4 = 2 x 0,5 = 1 mol.
nCO2 = nCH4 = 0,5 mol.
VO2 = 1 x 22,4 = 22,4 lít.
VCO2 = 0,5 x 22,4 = 11,2 lít.
Câu 9:
Phương Pháp hóa học để
a) Thu được khí CH4.
Dẫn Hỗn hợp khí qua dung dịch Ca(OH)2 dư, khí CO2 bị giữ lại do phản ứng tạo ra CaCO3, khí bay ra khỏi dung dịch là CH4 có lẫn hơi nước lên dùng CaO làm khô để thu được CH4 tinh khiết. Ta có phương trình hóa học như sau:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
b) Cho thu được khí CO2.
Cho CaCO3 thu được ở trên tác dụng với dung dịch HCl loãng ta sẽ thu được khí CO2. Làm lạnh ngưng tụ nước sẽ thu được CO2 tinh khiết. Ta có phương trình hóa học như sau:
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
5. Tìm hiểu về metan (CH4):
5.1. Metan (CH4) là gì?
Khí metan hay còn gọi là khí bùn ao có ký hiệu CH4.
Chúng là thành phần chính của khí dầu mỏ, khá phong phú trong tự nhiên và được hình thành trong quá trình xử lý, chưng cất hoặc sản xuất khí dầu mỏ và được tìm thấy trong nhiều hộ gia đình (ví dụ như trong bình gas
5.2. Tính chất vật lý của CH4:
| Trạng thái | Khí độc, không màu, không mùi, không vị. Dễ bắt chất, tạo lửa xanh. |
| Khả năng hòa tan | Không hòa tan trong các dung môi phân cực vì không có sự liên kết giữa các hidro, chúng chỉ tan trong dung môi không phân cực. |
| Nhiệt độ hóa lỏng | -162⁰C |
| Nhiệt độ hóa rắn | -183⁰C |
| Điểm bốc cháy | 537⁰C |
| Khối lượng riêng của metan | 0.717 kg/m3 |
| Tính dẫn diện | Không |
5.3. Tính chất hóa học của CH4:
Trên thực tế, khí metan có nhiều tính chất hóa học khác nhau. Tuy nhiên, metan có hai tính chất cơ bản và đặc trưng nhất, đó là khả năng phản ứng với oxi và clo ở những điều kiện phản ứng khác nhau.
-
Tác dụng với oxi
‐ Thí nghiệm: đốt metan với oxi.
‐ Hiện tượng:
-
Sau khi đốt có các giọt nước nhỏ bám trên thành ống nghiệm.
-
Đổ dung dịch nước vôi trong vào ống nghiệm sau khi đốt dung dịch thấy xuất hiện vẩn đục màu trắng.
-
Ống nghiệm nóng lên.
‐ Kết luận:
-
Khí metan tạo thành khí cacbonic và hơi nước.
-
Phản ứng tỏa nhiều nhiệt
-
Phương trình hóa học: CH4(k) + 2O2(k) → CO2(k) + 2H2O(h) (điều kiện nhiệt độ)
Chú ý: Hỗn hợp 1 thể tích khí metan và 2 thể tích khí oxi là Hỗn hợp gây nổ mạnh.
-
Tác dụng với Clo
‐ Thí nghiệm: Cho hỗn hợp khí metan và clo phản ứng với nhau trong bình kín, điều kiện có chiếu sáng.
‐ Hiện tượng:
-
Ban đầu Hỗn hợp có màu vàng của khí clo. Sau một thời gian, màu vàng nhạt dần rồi mất đi.
-
Thêm nước rồi nhúng quỳ tím vào bình thấy quỳ tím chuyển sang màu đỏ.
‐ Kết luận:
-
Metan đã phản ứng với Clo khi có ánh sáng, sản phẩm thu được sau phản ứng có tính axit nên khi cho quỳ tím ẩm vào thì quỳ tím chuyển sang màu đỏ.
-
Phương trình hóa học: CH4 + Cl2 → HCl + CH3Cl (clo metan)
-
Ở phản ứng này, nguyên tử hidro của metan bị thay thế bởi nguyên tử Clo, vì vậy được gọi là phản ứng thế. Nếu dùng dư Clo, toàn bộ nguyên tử Hidro có trong phân tử metan có thể bị thay thế hết bởi nguyên tử Clo.
5.4. Điều chế khí metan như thế nào?
Có nhiều cách để điều chế ra khí metan nhưng loại khí này thường được sản xuất và sử dụng nhiều nhất trong hai môi trường phổ biến là phòng thí nghiệm và công nghiệp.
-
Điều chế khí metan trong phòng thí nghiệm
Một số cách phổ biến hơn để tạo ra CH4 trong phòng thí nghiệm bao gồm:
Nếu cần khí mê-tan với số lượng nhỏ, natri axetat được đun nóng chung với vôi xôi tút hoặc được điều chế bằng cách cho nhôm cacbua phản ứng với nước.
‐ Điều chế CH4 từ nhôm cacbua:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
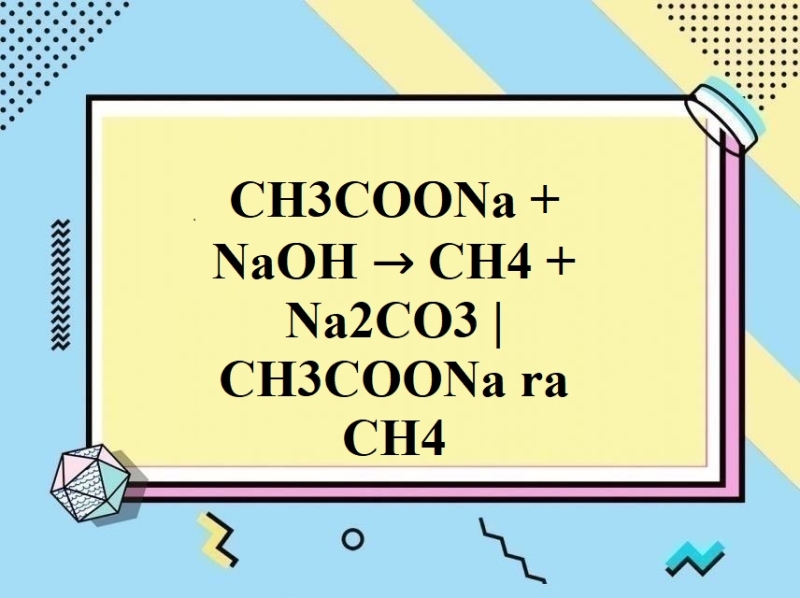
‐ Phản ứng muối natri axetat với xút tạo khí metan (nhiệt phân muối natri của axit cacboxylic):
CH3–COONa + NaOH →(CaO, nhiệt độ) Na2CO3 + CH4
‐ Cách điều chế metanol bằng phản ứng cộng hidro vào cacbon:
C + 2H2 →(nhiệt độ, Ni) CH4
‐ Cách điều chế CH4 từ khí CO:
CO + 3H2 →(nhiệt độ) H2O+CH4
Hoặc điều chế CH4 bằng cách khử các dẫn xuất methyl của các halogen, ancol hay carbonyl.
-
Điều chế metan trong công nghiệp
Trong công nghiệp, metan và các đồng đẳng được tách từ khí thiên nhiên và dầu mỏ. Đây là cách điều chế CH4 nhanh chóng và dễ dàng nhất.
5.4. Ứng dụng của CH4:
Metan là một trong những nguyên liệu quan trọng cần thiết cho sản xuất công nghiệp và đời sống hàng ngày của con người.
-
Sử dụng trong nhiên liệu
Do khả năng sinh nhiệt cao, mêtan đã trở thành nhiên liệu quan trọng được con người lựa chọn, dùng làm nhiên liệu cho động cơ điện, nhiệt hoặc ô tô.
Mêtan làm nhiên liệu cho lò đốt, nhà ở hoặc máy nước nóng, lò nung,… với cơ chế đốt cháy oxi để sinh nhiệt.
Metan đóng một vai trò quan trọng trong việc phát điện khi nó được đốt cháy làm nhiên liệu trong tua-bin khí. Trong các nhà máy nhiệt điện, khí mê tan được sử dụng làm nhiên liệu cùng với than để đạt hiệu suất tốt, đồng thời giảm thiểu nguy cơ gây ô nhiễm môi trường.
Vì hàm lượng metan của khí metan có thể đạt tới 98% nên nó có thể được sử dụng làm nhiên liệu cho động cơ ô tô.
Tuy nhiên, mức năng lượng thể tích của khí mê-tan trong than đá và các nhiên liệu khí khác thấp. Ở điều kiện bình thường, nhiệt lượng đốt cháy 1 lít khí metan đốt than vào khoảng 33-36 kJ. Đồng thời, nhiệt lượng thu được khi đốt cháy 1 lít xăng là 31.400 kJ, gấp 1000 lần so với khí mê-tan than. Do đó, các nhà nghiên cứu có thể khẳng định rằng carbon metan có thể được sử dụng ở dạng nén hoặc hóa lỏng làm nhiên liệu động cơ cho ô tô.
Một phân tích về nghiên cứu độc tính của ô tô chạy bằng khí đốt cho thấy kết quả tốt khi nhiên liệu xăng được thay thế bằng khí mê-tan carbon. Thành phần khí độc thải ra môi trường (tính bằng g/km) giảm đi nhiều lần: carbon monoxide 5-10 lần, hydrocarbon – 3 lần, và nhóm oxit nitơ này – trong 1,5 -2,5 lần…
Ngoài ra, khí mê-tan còn được gọi là “khí đốt tự nhiên” ở nhiều nơi – được lắp đặt trong các đường ống dẫn tới mọi ngôi nhà đều để sưởi ấm và nấu ăn.