CH3COOH + NaHCO3 → CH3COONa + H2O + CO2 là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem.
Mục lục bài viết
- 1 1. Phương trình phản ứng CH3COOH tác dụng NaHCO3:
- 2 2. Phân tích Phương trình phản ứng hóa học CH3COOH tác dụng NaHCO3:
- 2.1 2.1. Điều kiện xảy ra phản ứng CH3COOH tác dụng NaHCO3:
- 2.2 2.2. Cách thực hiện phản ứng:
- 2.3 2.3. Các cách nhận biết phản ứng:
- 2.4 2.4. Cách cân bằng phương trình hóa học:
- 2.5 2.5. Ứng dụng của phản ứng:
- 2.6 2.6. Bản chất của các chất tham gia phản ứng:
- 2.7 2.7. Tính chất hóa học của axit axetic:
- 3 3. Bài tập vận dụng liên quan:
- 4 4. Hướng dẫn lời giải:
1. Phương trình phản ứng CH3COOH tác dụng NaHCO3:
15CH3COOH + 10NaHCO3 → 10CH3COONa + 2H2O + 20CO2
– Một trong những phản ứng phổ biến xảy ra trong cuộc sống hàng ngày là phản ứng giữa axit axetic và natri bicacbonat. Axit axetic, còn được gọi là axit ethanoic hoặc giấm, là một axit hữu cơ yếu có công thức hóa học CH3COOH.
– Natri bicacbonat, còn được gọi là muối nở, là một chất rắn màu trắng có công thức hóa học NaHCO3. Khi hai chất này được trộn lẫn với nhau, chúng sẽ trải qua phản ứng chuyển vị kép, nghĩa là các ion dương và âm trong chất phản ứng đổi chỗ cho nhau để tạo thành hợp chất mới.
– Các sản phẩm của phản ứng này là natri axetat, nước và carbon dioxide. Natri axetat là một loại muối có công thức hóa học CH3COONa. Nước là chất lỏng có công thức hóa học là H2O. Carbon dioxide là một loại khí có công thức hóa học CO2.
Phản ứng này là một ví dụ về phản ứng trung hòa axit-bazơ, có nghĩa là axit và bazơ phản ứng tạo thành muối và nước. Nó cũng là một ví dụ về phản ứng tiến hóa khí, có nghĩa là một trong những sản phẩm là khí thoát ra khỏi dung dịch. Phản ứng này có thể được quan sát bằng sự hình thành bong bóng khi giấm và muối nở được trộn với nhau.
2. Phân tích Phương trình phản ứng hóa học CH3COOH tác dụng NaHCO3:
2.1. Điều kiện xảy ra phản ứng CH3COOH tác dụng NaHCO3:
Phản ứng CH3COOH + NaHCO3 → CH3COONa + H2O + CO2 là phản ứng trao đổi ion giữa axit axetic và natri bicacbonat, tạo ra muối natri axetat, nước và khí cacbonic. Để xảy ra phản ứng này, cần có một số điều kiện như sau:
– Nồng độ của axit axetic và natri bicacbonat phải đủ cao để có thể tạo ra dung dịch bão hòa hoặc gần bão hòa.
– Nhiệt độ của dung dịch phải cao hơn nhiệt độ phân hủy của natri bicacbonat, khoảng 50°C trở lên, để khí cacbonic có thể thoát ra khỏi dung dịch.
– Áp suất của dung dịch phải thấp hơn áp suất bão hòa của khí cacbonic, để khí này không bị hòa tan trở lại vào dung dịch.
– Phải có một chất xúc tác hoặc một chất kích thích để tăng tốc độ phản ứng, ví dụ như một chất kiềm hoặc một chất oxy hóa.
2.2. Cách thực hiện phản ứng:
Để thực hiện phản ứng CH3COOH + NaHCO3 → CH3COONa + H2O + CO2, bạn cần chuẩn bị các dụng cụ và chất hóa học sau:
– Ống nghiệm, giá đỡ ống nghiệm, bình đựng nước, ống dẫn khí, que đóm.
– Dung dịch axit axetic (CH3COOH), natri bicacbonat (NaHCO3), dung dịch phenolphtalein.
Các bước thực hiện như sau:
– Đổ một lượng vừa đủ dung dịch axit axetic vào ống nghiệm, nhỏ vài giọt dung dịch phenolphtalein vào ống nghiệm. Lắc đều ống nghiệm để dung dịch có màu hồng nhạt.
– Cho một ít natri bicacbonat vào ống nghiệm, lắc nhẹ ống nghiệm để phản ứng xảy ra. Quan sát hiện tượng và ghi nhận kết quả.
– Cắm ống dẫn khí vào ống nghiệm, đưa đầu kia của ống dẫn khí vào bình đựng nước. Đưa que đóm đã châm lửa vào bình đựng nước. Quan sát hiện tượng và ghi nhận kết quả.
Kết quả:
– Khi cho natri bicacbonat vào ống nghiệm, có khí thoát ra kèm theo tiếng xèo xèo. Dung dịch trong ống nghiệm mất màu hồng, chuyển sang màu trong suốt. Đây là do phản ứng trung hòa giữa axit axetic và natri bicacbonat tạo ra muối natri axetat (CH3COONa), nước (H2O) và khí cacbonic (CO2).
– Khi đưa que đóm vào bình đựng nước, que đóm tắt ngay lập tức. Đây là do khí cacbonic không cháy được và không duy trì được sự cháy của que đóm.
2.3. Các cách nhận biết phản ứng:
– Phản ứng xảy ra khi trộn dung dịch CH3COOH và dung dịch NaHCO3 hoặc khi cho NaHCO3 vào giấm (dung dịch CH3COOH loãng).
– Phản ứng tạo ra khí CO2 bay lên, có thể thu được bằng cách đốt cháy khí này với ngọn lửa đỏ hoặc cho khí này đi qua dung dịch nước vôi trong (Ca(OH)2) để tạo kết tủa trắng CaCO3.
– Phản ứng cũng tạo ra muối natri axetat (CH3COONa) và nước (H2O). Ta có thể nhận biết muối này bằng cách cho dung dịch FeCl3 vào dung dịch sau phản ứng để tạo kết tủa đỏ gạch Fe(OH)3. Nước có thể nhận biết bằng cách đo nhiệt độ của dung dịch sau phản ứng, nếu nhiệt độ tăng lên thì có sự xuất hiện của nước.
2.4. Cách cân bằng phương trình hóa học:
Để cân bằng phương trình CH3COOH + NaHCO3 → CH3COONa + H2O + CO2, ta cần tìm hệ số của các chất tham gia và sản phẩm sao cho số nguyên tử của mỗi nguyên tố bên trái bằng số nguyên tử của nguyên tố đó bên phải. Một cách cân bằng phương trình chính xác nhất là sử dụng phương pháp ion electron, trong đó ta xét riêng các phản ứng oxi hóa khử xảy ra ở môi trường axit và môi trường bazơ, rồi cộng lại để được phương trình hoàn chỉnh. Cụ thể, ta có các bước sau:
– Xác định chất oxi hóa và chất khử: CH3COOH là chất oxi hóa, NaHCO3 là chất khử.
– Viết phương trình oxi hóa khử ở môi trường axit: CH3COOH + 2H+ + 2e- → CH3COO- + H2O (phản ứng oxi hóa) và NaHCO3 + H2O → Na+ + CO2 + 2OH- + 2e- (phản ứng khử).
– Cân bằng số electron cho hai phương trình: nhân phương trình oxi hóa với 2 và phương trình khử với 1, ta được: 2CH3COOH + 4H+ + 4e- → 2CH3COO- + 2H2O và NaHCO3 + H2O → Na+ + CO2 + 2OH- + 2e-.
– Cộng hai phương trình lại để loại bỏ electron: ta được: 2CH3COOH + NaHCO3 → 2CH3COO- + Na+ + CO2 + H2O.
– Viết lại phương trình với dạng ion phân tử: ta được: CH3COOH + NaHCO3 → CH3COONa + H2O + CO2.
2.5. Ứng dụng của phản ứng:
Phản ứng này có nhiều ứng dụng trong cuộc sống, chẳng hạn như:
– Tạo ra khí CO2 để nở bánh, bánh quy, bánh mì và các sản phẩm làm bằng bột mì. Khi nhiệt độ tăng, natri bicacbonat phân hủy sinh ra khí CO2, làm cho bột mì nở lên và tạo ra các lỗ nhỏ trong sản phẩm.
– Làm sạch các vết ố trên kim loại, gốm sứ, thủy tinh và các bề mặt khác. Khi phun dung dịch axit axetic lên các vết ố, phản ứng sinh ra khí CO2 và muối natri axetat, có tác dụng làm tan các chất bẩn và tẩy trắng các vết ố.
– Làm thuốc giảm đau, chống viêm và kháng khuẩn. Khi uống dung dịch axit axetic pha loãng, phản ứng sinh ra muối natri axetat và khí CO2 trong dạ dày. Muối natri axetat có tác dụng làm giảm độ axit của dịch vị, giảm cảm giác đau bụng và viêm loét. Khí CO2 có tác dụng kích thích tiêu hóa và ngăn ngừa sự phát triển của vi khuẩn gây bệnh.
2.6. Bản chất của các chất tham gia phản ứng:
– Bản chất của CH3COOH (Axit axetic): CH3COOH là một axit yếu thuộc nhóm axit monoprotic có khả năng tác dụng được với hidrocacbonat tạo ra axetat kim loại tương ứng, nước và cacbonic.
– Bản chất của NaHCO3 (Natri hidrocacbonat): NaHCO3 là một muối axit nhưng thể hiện tính axit yếu tác dụng được với axit.
2.7. Tính chất hóa học của axit axetic:
Axit axetic CH3COOH (axit etanoic) là một axit hữu cơ, mạnh hơn axit cacbonic. Nó được hình thành bằng cách kết hợp nhóm metyl CH3 với cacboxyl COOH.
Nhôm thụ động với axit axetic, vì khi phản ứng, nó tạo thành một màng oxit nhôm mỏng trên bề mặt, ngăn ngừa sự ăn mòn. Vì vậy, nhà sản xuất thường sử dụng thùng nhôm để đựng dung dịch này.
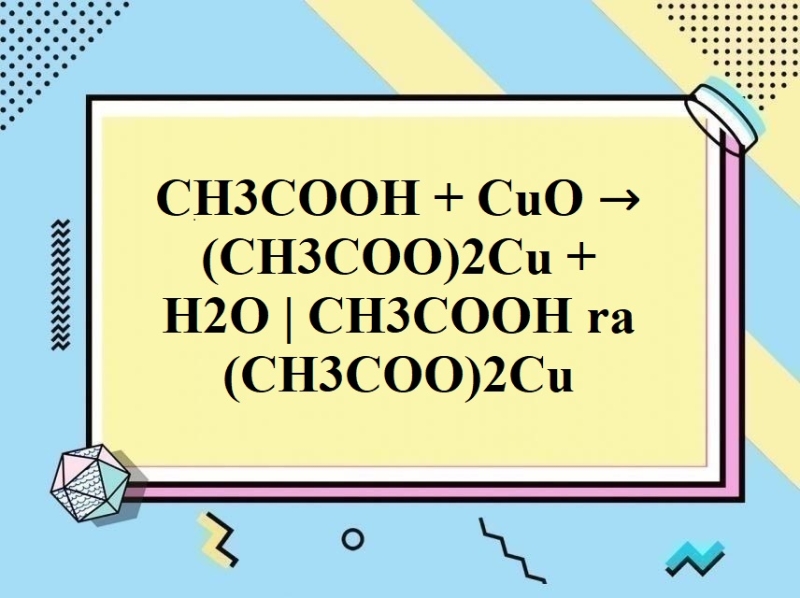
– Axit axetic tác dụng với oxit bazơ, bazơ tạo thành muối và nước
CH3COOH + NaOH → CH3COONa + H2O
CH3COONa: (Natri axetat)
CH3COOH + CaO → (CH3COO)2Ca + H2O
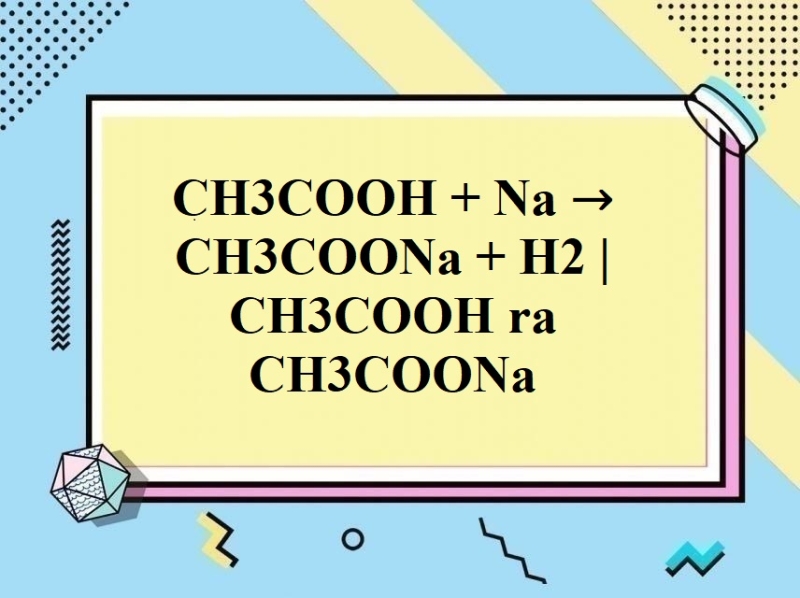
– Axit axetic tác dụng với kim loại (trước H) giải phóng H2
2CH3COOH + 2Na → 2CH3COONa + H2↑
– Axit axetic tác dụng với muối của axit yếu hơn
2CH3COOH + CaCO3 → (CH3COO)2C
– Phản ứng thế halogen vào gốc hydrocacbon
Thế halogen vào gốc hydrocacbon ở nhiệt độ( 90 – 100oC)
Cl2 + CH3COOH → ClCH2COOH + HCl
– Axit axetic tác dụng với rượu tạo ra este và nước
Tác dụng với rượu tạo ra este và nước.(xúc tác là H2SO4 đặc, nóng)
CH3COOH + HO-C2H5 →CH3COOC2H5 + H2O
3. Bài tập vận dụng liên quan:
Câu 1: Đun nóng axit axetic với rượu etylic có axit sunfuric làm xúc tác thì người ta thu được một chất lỏng không màu, mùi thơm, không tan trong nước và nổi trên mặt nước. Sản phẩm đó là
A. CH3Cl.
B. CH3COONa.
C. CH3COOC2H5.
D. C2H4.
Câu 2: Chất nào dưới đây làm quỳ tím chuyển sang màu đỏ?
A. CH3COOH.
B. CH3CH2OH.
C. CH2=CH2.
D. CH3CHO.
Câu 3: Trong công nghiệp một lượng lớn axit axetic được điều chế bằng cách
A. Nhiệt phân CH4 rồi sau đó làm lạnh nhanh
B. Lên men dung dịch rượu C2H5OH
C. oxi hóa C2H6 có xúc tác và nhiệt độ thích hợp
D. oxi hóa C4H10 có xúc tác và nhiệt độ thích hợp
Câu 4: Hòa tan hoàn toàn 4,8 gam Mg vào dung dịch CH3COOH. Thể tích khí H2 thoát ra (ở đktc) là
A. 4,48 lít.
B. 1,12 lít.
C. 2,24 lít.
D. 3,36 lít.
Câu 5: Khi cho bột NaHCO3 vào dung dịch CH3COOH, hiện tượng xảy ra là
A. Chất rắn tan, có bọt khí
B. Chất rắn tan ra
C. Chất rắn không tan, có bọt khí
D. Có chất kết tủa trắng
Câu 6: Axit axetic (CH3COOH) tác dụng được với tất cả các chất trong dãy nào sau đây?
A. Na, CuO, H2SO4
B. KOH, Na, BaCO3
C. KOH, Cu, KCl
D. Na, NaCl, CuO
4. Hướng dẫn lời giải:
Câu 1:
Đáp án: C. CH3COOC2H5
Câu 2:
Đáp án: A. CH3COOH
Câu 3:
Đáp án: D. oxi hóa C4H10 có xúc tác và nhiệt độ thích hợp
Câu 4:
Đáp án: A. 4,48 lít.
Câu 5:
Đáp án: A. Chất rắn tan, có bọt khí
Giải thích:
Khi cho bột NaHCO3 vào dung dịch CH3COOH, hiện tượng xảy ra là chất rắn tan, có bọt khí.
Phương trình phản ứng
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2
Câu 6:
Đáp án: B. KOH, Na, BaCO3
Giải thích:
Loại đáp án A vì axit axetic không tác dụng được với HCl.
Loại đáp án C vì axit axetic không tác dụng được với Cu (kim loại đứng sau H)
Loại đáp án D, axit axetic không tác dung được với NaCl
Vậy Axit axetic (CH3COOH) tác dụng được với tất cả các chất trong dãy NaOH, Na, CaCO3
Đáp án B đúng:
Phương trình hóa học xảy ra
CH3COOH + KOH → CH3COOK+ H2O
CH3COOH + Na → CH3COONa + 1/2 H2
2CH3COOH + BaCO3 → (CH3COO)2Ba + CO2 + H2O