CH3COOH + Cu(OH)2 → (CH3COO)2Cu + H2O là tài liệu vô cùng bổ ích giúp quý độc giả tiết kiệm thời gian và công sức trong việc giải các bài tập về hóa học. Sau đây là nội dung chi tiết mời các bạn cùng tham khảo.
Mục lục bài viết
1. CH3COOH + Cu(OH)2 → (CH3COO)2Cu + H2O:
1.1. Phương trình phản ứng:
CH3COOH + Cu(OH)2 → (CH3COO)2Cu + H2O
1.2. Điều kiện phản ứng xảy ra CH3COOH + Cu(OH)2 → (CH3COO)2Cu + H2O:
Nhiệt độ bình thường
Cho 1 – 2 ml CuSO4 5% vào ống nghiệm, tiếp tục nhỏ tiếp NaOH 10% vào ống nghiệm, sau phản ứng thu được kết tủa.
– Gạn lấy kết tủa sau đó cho tác dụng với dung dịch CH3COOH.
1.3. Hiện tượng phản ứng giữa CH3COOH + Cu(OH)2 → (CH3COO)2Cu + H2O:
– Chất rắn Cu(OH)2 tan dần, sau phản ứng thu được dung dịch có màu xanh.
2. Phương trình rút gọn của CH3COOH + Cu(OH)2 → (CH3COO)2Cu + H2O:
Bước 1: Viết phương trình phân tử:
Cu(OH)2 + 2CH3COOH → (CH3COO)2Cu + 2H2O
Bước 2: Viết phương trình ion đầy đủ bằng cách: chuyển các chất vừa dễ tan, vừa điện li mạnh thành ion; các chất điện li yếu, chất kết tủa, chất khí để nguyên dưới dạng phân tử:
Cu(OH)2 + 2CH3COO– + 2H+ → 2CH3COO– + Cu2+ + 2H2O
Bước 3: Viết phương trình ion thu gọn từ phương trình ion đầy đủ bằng cách lược bỏ đi các ion giống nhau ở cả hai vế:
Cu(OH)2 + 2H+ → Cu2+ + 2H2O
Mở rộng kiến thức:
Axit axetic có công thức phân tử: C2H4O2.
Phân tử khối: 60.
Tính chất vật lí
Axit axetic là chất lỏng, không màu, vị chua, tan vô hạn trong nước.
Dung dịch axit axetic nồng độ từ 2 – 5 % dùng làm giấm ăn.
Cấu tạo phân tử
Axit axetic có công thức cấu tạo:
CH3COOH + Cu(OH)2 → (CH3COO)2Cu + H2O | Axit axetic + Cu(OH)2
Trong phân tử axit axetic có nhóm –COOH làm cho phân tử có tính axit.
Tính chất hóa học
a. Axit axetic có tính chất của một axit + Làm đổi màu quỳ tím sang màu đỏ.
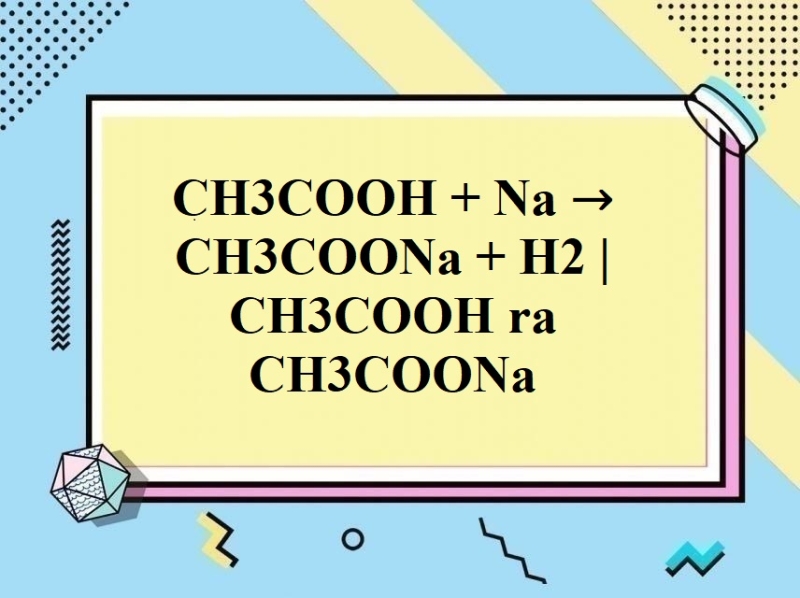
+ Tác dụng với kim loại (trước H) giải phóng H2
Ví dụ:
2CH3COOH + 2Na → 2CH3COONa + H2 ↑
2CH3COOH + Zn → (CH3COO)2Zn + H2 ↑
+ Tác dụng với bazơ → muối và nước
Ví dụ:
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + Ba(OH)2 → (CH3COO)2Ba + 2H2O
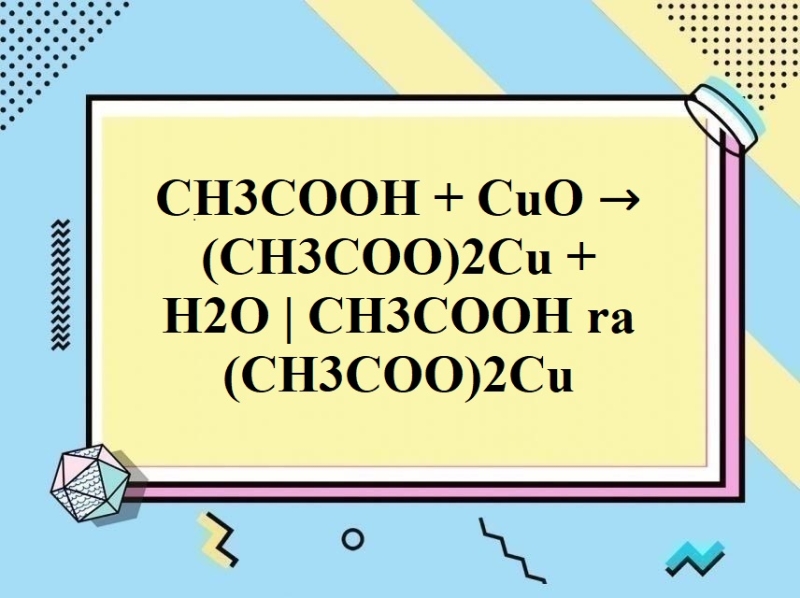
+ Tác dụng với oxit bazơ → muối và nước
Ví dụ:
2CH3COOH + CaO → (CH3COO)2Ca + H2O
2CH3COOH + Na2O → 2CH3COONa + H2O
+ Tác dụng với muối của axit yếu hơn
Ví dụ:
2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 ↑ + H2O.
2CH3COOH + Na2CO3 → 2CH3COONa + CO2 ↑ + H2O
Chú ý: Axit axetic là axit yếu.
b. Tác dụng với rượu etylic tạo ra este và nước
CH3COOH + Cu(OH)2 → (CH3COO)2Cu + H2O | Axit axetic + Cu(OH)2
– Hiện tượng: Sản phẩm thu được là chất lỏng, mùi thơm, không tan trong nước, nổi trên mặt nước gọi là este.
– Phương trình hóa học
– Este thu được là etylaxetat dùng làm dung môi trong công nghiệp.
– Lưu ý: Sản phẩm của phản ứng giữa axit hữu cơ và rượu là este.
Ứng dụng
Axit axetic được dùng để điều chế dược phẩm, thuốc diệt cỏ, diệt côn trùng, phẩm nhuộm, tơ sợi nhân tạo, pha giấm ăn…
Điều chế
Axit axetic được điều chế theo các phản ứng sau:
– Trong công nghiệp, đi từ butan C4H10:
– Sản xuất giấm ăn, thường dùng phương pháp lên men dung dịch rượu etylic loãng.
3. Bài tập vận dụng liên quan:
Câu 1: Tính chất vật lý của axit axetic là
A. Chất lỏng, không màu, vị chua, tan vô hạn trong nước
B. Chất khí, không màu, vị chua, không tan trong nước
C. Chất lỏng, không màu, không vị, tan vô hạn trong nước
D. Chất lỏng, màu xanh, không vị, tan vô hạn trong nước
Hướng dẫn giải:
Đáp án A
Tính chất vật lý của axit axetic là: Chất lỏng, không màu, vị chua, tan vô hạn trong nước.
Câu 2: Hòa tan hoàn toàn 2,3 gam natri vào dung dịch CH3COOH. Thể tích khí H2 thoát ra ở đktc là
A. 0,56 lít
B. 3,36 lít
C. 1,12 lít
D. 2,24 lít
Hướng dẫn giải:
Đáp án C
Số mol Na là: nNa = 2,323″>2,323 = 0,1 mol
Câu 3: Chất nào sau đây làm đổi màu quỳ tím?
A. CH3OH
B. CH2=CH2
C. CH3CH2OH
D. CH3COOH
Hướng dẫn giải:
Đáp án D
Chất làm đổi màu quỳ tím là: CH3COOH vì CH3COOH có tính axit làm quỳ tím hóa đỏ.
Câu 4: Cho các phát biểu sau:
(1) Trong công nghiệp, axit axetic được điều chế từ butan C4H10.
(2) Trong phân tử axit axetic có nhóm –COOH làm cho phân tử có tính axit.
(3) Axit axetic tác dụng với bazơ tạo thành muối và nước.
(4) Axit axetic có tính chất của một axit.
Số phát biểu đúng là
A. 1
B. 2
C. 3
D. 4
Hướng dẫn giải:
Đáp án D
Các phát biểu (1), (2), (3), (4) đều đúng.
Câu 5: Trung hòa 200 ml dung dịch axit axetic 0,25M bằng dung dịch NaOH 0,25M. Thể tích dung dịch NaOH cần dùng là
A. 0,1 lít
B. 0,2 lít
C. 0,3 lít
D. 0,4 lít
Hướng dẫn giải:
Đáp án B
Số mol của CH3COOH là:
nCH3COOH=0,25.0,2″>=0,25.0,2 = 0,05 mol
Phương trình phản ứng:
CH3COOH+NaOH→CH3COONa+H2O0,050,05 (mol)”>
Theo phương trình phản ứng ta có: nNaOH = 0,05 mol
Thể tích dung dịch NaOH cần dùng là:
V = nCM=0,050,25″>=0,050,25 = 0,2 lít
Câu 6: Công thức phân tử của axit axetic là
A. CH2O2
B. C2H6O2
C. C2H4O2
D. C2H4O
Hướng dẫn giải:
Đáp án C
Công thức phân tử của axit axetic là C2H4O2.
Câu 7: Hòa tan hoàn toàn 4,8 gam Mg vào dung dịch CH3COOH, sau phản ứng thấy thoát ra V lít khí H2 ở đktc. Giá trị của V là
A. 4,48 lít
B. 5,60 lít
C. 3,36 lít
D. 9,80 lít
Hướng dẫn giải:
Đáp án A
Số mol của Mg là: nMg = 4,824″>4,824 = 0,2 mol
Phương trình phản ứng:
2CH3COOH+Mg→Mg+H20,2 0,2 (mol)”>20,2 0,2 (mol)
Theo phương trình phản ứng ta có: nH2″>2= 0,2 mol
Thể tích khí H2 là: V = 0,2.22,4 = 4,48 lít
Câu 8: Giấm ăn là dung dịch axit axetic có nồng độ từ
A. 2% – 5%
B. 6% – 10%
C. 10% – 15%
D. 16% – 18%
Hướng dẫn giải:
Đáp án A
Giấm ăn là dung dịch axit axetix có nồng độ từ 2% – 5%
Câu 9: Hòa tan hoàn toàn 20 gam CaCO3 vào đung dịch CH3COOH. Thể tích CO2 thoát ra ở đktc là
A. 1,12 lít
B. 5,6 lít
C. 4,48 lít
D. 13,44 lít
Hướng dẫn giải:
Đáp án C
Số mol của CaCO3 là: nCaCO3=20100″>3=20100 = 0,2 mol
Phương trình phản ứng:
CaCO3+2CH3COOH→Ca+CO2+H2O0,2 0,2 (mol)”>
Theo phương trình phản ứng ta có: nCO2″>2= 0,2 mol
Thể tích CO2 thoát ra ở đktc là VCO2″>2= 0,2.22,4 = 4,48 lít
Câu 10: Cho 8 gam NaOH tác dụng hết với dung dịch CH3COOH, sau phản ứng thu được m gam muối. Giá trị của m là
A. 14,6 gam
B. 16,4 gam
C. 18,6 gam
D. 19,8 gam
Hướng dẫn giải:
Đáp án B
Số mol của NaOH là: nNaOH = 840″>840 = 0,2 mol
Phương trình phản ứng:
CH3COOH+NaOH→CH3COONa+H2O0,2 0,2 (mol)”>
Theo phương trình phản ứng ta có: nCH3COONa=0,2″>=0,2 (mol)
Khối lượng của CH3COONa là: m = 0,2.82 = 16,4 gam.
Cách cân bằng phương trình CH3COOH + Cu(OH)2 → (CH3COO)2Cu + H2O:
Để cân bằng phương trình hóa học CH3COOH + Cu(OH)2 → (CH3COO)2Cu + H2O, ta cần xác định số hợp chất của từng nguyên tố trong phương trình và điều chỉnh các hệ số phù hợp.
Bước 1: Viết phương trình chưa cân bằng:
CH3COOH + Cu(OH)2 → (CH3COO)2Cu + H2O
Bước 2: Xác định số nguyên tử cho mỗi nguyên tố trong phương trình chưa cân bằng:
C: 3 (CH3COOH) + 1 (Cu(OH)2) → 2 (CH3COO)2Cu + 0 (H2O) H: 4 (CH3COOH) + 2 (Cu(OH)2) → 4 (CH3COO)2Cu + 2 (H2O) O: 2 (CH3COOH) + 2 (Cu(OH)2) → 4 (CH3COO)2Cu + 1 (H2O) Cu: 1 (CH3COOH) + 1 (Cu(OH)2) → 2 (CH3COO)2Cu + 0 (H2O)
Bước 3: Điều chỉnh hệ số để cân bằng số nguyên tử của mỗi nguyên tố. Bắt đầu bằng cách cân bằng số nguyên tử của các nguyên tố không phải hidro và oxi:
CH3COOH + Cu(OH)2 → (CH3COO)2Cu + H2O
Ta thấy rằng nguyên tố carbon (C) đã cân bằng (3 = 3) và đồng (Cu) cũng đã cân bằng (1 = 1).
Bây giờ ta chỉ cần điều chỉnh số nguyên tử hidro (H) và oxi (O). Ta thấy rằng số nguyên tử hidro (H) ở phía trái phương trình là 4, còn ở phía phải là 2 (2 trong (CH3COO)2Cu).
Để cân bằng số nguyên tử hidro, ta sẽ thêm hệ số 2 phía trước sản phẩm H2O:
CH3COOH + Cu(OH)2 → (CH3COO)2Cu + 2H2O
Bây giờ ta cần điều chỉnh số nguyên tử oxi (O). Ta thấy rằng số nguyên tử oxi (O) ở phía trái phương trình là 2 (1 trong CH3COOH và 1 trong Cu(OH)2), còn ở phía phải là 4 (2 trong (CH3COO)2Cu và 2 trong H2O).
Để cân bằng số nguyên tử oxi, ta sẽ thêm hệ số 2 phía trước CH3COOH:
2CH3COOH + Cu(OH)2 → (CH3COO)2Cu + 2H2O
Bây giờ, phương trình đã được cân bằng về số nguyên tử cho mỗi nguyên tố:
2CH3COOH + Cu(OH)2 → (CH3COO)2Cu + 2H2O
Hy vọng rằng các bước trên đã giúp bạn cân bằng phương trình hóa học này!
Các mẹo để cân bằng phương trình hóa học chuẩn nhất CH3COOH + Cu(OH)2 → (CH3COO)2Cu + H2O:
Để cân bằng phương trình hóa học, bạn cần điều chỉnh hệ số phần tử phía trước các chất trong phương trình sao cho số nguyên tử của mỗi nguyên tố trên cả hai bên của phản ứng bằng nhau. Trong trường hợp của phương trình này:
CH3COOH + Cu(OH)2 → (CH3COO)2Cu + H2O
Bước 1: Xác định số nguyên tử của từng nguyên tố trên cả hai bên phương trình.
Phía trái: C: 2 (1 từ CH3COOH và 1 từ (CH3COO)2Cu) H: 4 (2 từ CH3COOH và 2 từ H2O) O: 4 (2 từ CH3COOH và 2 từ Cu(OH)2)
Phía phải: C: 4 (2 từ (CH3COO)2Cu) H: 2 (2 từ H2O) O: 4 (2 từ (CH3COO)2Cu và 2 từ Cu(OH)2)
Bước 2: Cân bằng số nguyên tử của từng nguyên tố bằng cách thêm hệ số phù hợp vào các chất.
CH3COOH + Cu(OH)2 → (CH3COO)2Cu + 2H2O
Bước 3: Kiểm tra lại phương trình để đảm bảo rằng số nguyên tử của mỗi nguyên tố trên cả hai bên phương trình là bằng nhau:
Phía trái: C: 2 (1 từ CH3COOH và 1 từ (CH3COO)2Cu) H: 6 (2 từ CH3COOH và 4 từ H2O) O: 6 (2 từ CH3COOH và 4 từ Cu(OH)2)
Phía phải: C: 2 (2 từ (CH3COO)2Cu) H: 6 (6 từ H2O) O: 6 (2 từ (CH3COO)2Cu và 4 từ Cu(OH)2)
Bây giờ, phương trình đã được cân bằng: CH3COOH + Cu(OH)2 → (CH3COO)2Cu + 2H2O.