CH3COOH + CuO → (CH3COO)2Cu + H2O được biên soạn hướng dẫn bạn đọc trả lời câu hỏi liên quan đến CH3COOH tác dụng với CuO. Cũng như đưa ra các nội dung câu hỏi bài tập liên quan đến tính chất hóa học của axit Axetic.
Mục lục bài viết
- 1 1. Phương trình phản ứng Hóa học axit Axetic tác dụng với CuO:
- 2 2. Phân tích Phương trình phản ứng Hóa học axit Axetic tác dụng với CuO:
- 2.1 2.1. Điều kiện xảy ra giữa hai chất CH3COOH và CuO:
- 2.2 2.2. Nhận biết phản ứng axit Axetic tác dụng với CuO:
- 2.3 2.3. Cách thực hiện phản ứng axit Axetic tác dụng với CuO:
- 2.4 2.4. Phương trình ion của phản ứng axit Axetic tác dụng với CuO:
- 2.5 2.5. Cách cân bằng Phương trình axit Axetic tác dụng với CuO:
- 2.6 2.6. Tính chất hóa học của Axit axetic:
- 3 3. Bài tập vận dụng liên quan và lời giải:
1. Phương trình phản ứng Hóa học axit Axetic tác dụng với CuO:
2CH3COOH + CuO ⟶ (CH3COO)2Cu + 2H2O
Phản ứng giữa axit axetic (CH3COOH) và đồng oxit (CuO) là một ví dụ về phản ứng trung hòa, trong đó axit và bazơ phản ứng tạo thành muối và nước. Muối được tạo ra trong trường hợp này là đồng axetat ((CH3COO)2Cu), là một hợp chất kết tinh màu lam lục.
Để thực hiện phản ứng này, người ta có thể hòa tan axit axetic trong nước và thêm bột đồng oxit. Hỗn hợp sẽ chuyển sang màu xanh lam khi đồng axetat hình thành và kết tủa ra khỏi dung dịch. Phản ứng tỏa nhiệt, nghĩa là nó giải phóng nhiệt ra môi trường xung quanh. Độ pH của dung dịch sẽ tăng lên khi axit được trung hòa bởi bazơ.
2. Phân tích Phương trình phản ứng Hóa học axit Axetic tác dụng với CuO:
2.1. Điều kiện xảy ra giữa hai chất CH3COOH và CuO:
Phản ứng CH3COOH + CuO → (CH3COO)2Cu + H2O là phản ứng oxi hóa khử xảy ra giữa axit axetic và đồng (II) oxit. Để phản ứng xảy ra, cần có một số điều kiện như sau:
– Nhiệt độ: Phản ứng này có thể được thực hiện trong điều kiện nhiệt độ phòng, nhưng cần có một chất xúc tác như axit sunfuric để tăng tốc độ phản ứng.
– Lượng chất: Phản ứng xảy ra khi có đủ lượng cả hai chất tham gia. Theo phương trình cân bằng, một mol CH3COOH cần phản ứng với một mol CuO để tạo ra một mol (CH3COO)2Cu và một mol H2O. Nếu thiếu bất kỳ chất nào, phản ứng sẽ không hoàn toàn.
– Môi trường: Phản ứng xảy ra khi môi trường có tính axit nhẹ. Nếu môi trường quá kiềm, phản ứng sẽ bị ngược lại, tạo ra CH3COOH và Cu(OH)2. Nếu môi trường quá axit, phản ứng sẽ bị ức chế, do sự cạnh tranh của các ion H+ với ion CH3COO-.
2.2. Nhận biết phản ứng axit Axetic tác dụng với CuO:
Để nhận biết phản ứng này, ta có thể dựa vào một số tính chất sau:
– Axit axetic có mùi chua đặc trưng, có công thức hóa học là CH3COOH hoặc C2H4O2. Nó là một chất lỏng không màu, tan tốt trong nước và các dung môi hữu cơ.
– Đồng oxit có màu đen, có công thức hóa học là CuO, là một chất rắn không tan trong nước, nhưng tan được trong các axit loãng.
– Đồng axetat có màu xanh lam, có công thức hóa học là (CH3COO)2Cu hoặc C4H6CuO4. Là một chất rắn tan được trong nước và các dung môi hữu cơ.
– Nước là chất lỏng không màu, không mùi, không vị, có công thức hóa học là H2O.
Khi cho axit axetic và đồng oxit phản ứng với nhau, ta sẽ thấy màu đen của đồng oxit biến thành màu xanh lam của đồng axetat, kèm theo sự thoát ra nhiệt và nước. Đây là những dấu hiệu cho thấy phản ứng đã xảy ra.
2.3. Cách thực hiện phản ứng axit Axetic tác dụng với CuO:
Để thực hiện phản ứng này, ta cần chuẩn bị các dụng cụ và chất tham gia:
– Một ống nghiệm chứa dung dịch axit axetic đậm đặc.
– Một miếng đồng (II) oxit rắn.
– Một que thủy tinh để khuấy.
– Một bình cầu hoặc một bình cầu có lỗ để đun nóng.
Các bước thực hiện phản ứng như sau:
– Cho miếng đồng (II) oxit vào ống nghiệm chứa dung dịch axit axetic.
– Đun nóng ống nghiệm trên ngọn lửa hoặc bình cầu cho đến khi thấy có khí thoát ra và dung dịch chuyển sang màu xanh lam.
– Khuấy nhẹ dung dịch bằng que thủy tinh để tăng tốc độ phản ứng và đảm bảo sự tiếp xúc giữa các chất tham gia.
– Sau khi phản ứng kết thúc, để nguội dung dịch và quan sát kết quả. Ta sẽ thấy có kết tủa màu xanh lam là đồng (II) axetat và có khí không màu không mùi là nước bay hơi.
2.4. Phương trình ion của phản ứng axit Axetic tác dụng với CuO:
Phương trình ion rút gọn của phản ứng:
CuO + 2H+ + 2e- → Cu2+ + H2O
2CH3COOH → 2CH3COO- + 2H+ + 2e-
Phương trình ion rút gọn có thể được cộng lại để thu được phương trình phản ứng ban đầu. Phản ứng này có thể được sử dụng để chứng minh tính chất oxi hóa của axit axetic và tính chất khử của đồng (II) oxit.
2.5. Cách cân bằng Phương trình axit Axetic tác dụng với CuO:
Để cân bằng phương trình CH3COOH + CuO → (CH3COO)2Cu + H2O chính xác nhất, ta cần tuân theo các bước sau:
– Bước 1: Viết phương trình phản ứng chưa cân bằng với các hệ số là 1.
– Bước 2: Đếm số nguyên tử của mỗi nguyên tố ở hai vế của phương trình.
– Bước 3: Chọn một nguyên tố có số nguyên tử khác nhau ở hai vế để điều chỉnh hệ số. Thường chọn nguyên tố có số nguyên tử lớn nhất hoặc có trong nhiều chất nhất.
– Bước 4: Điều chỉnh hệ số của chất chứa nguyên tố đó sao cho số nguyên tử của nguyên tố đó bằng nhau ở hai vế. Lặp lại bước này cho đến khi tất cả các nguyên tố đều cân bằng.
– Bước 5: Kiểm tra lại kết quả bằng cách đếm lại số nguyên tử của mỗi nguyên tố ở hai vế.
Áp dụng các bước trên, ta có:
– Bước 1: CH3COOH + CuO → (CH3COO)2Cu + H2O
– Bước 2: Vế trái: C = 2, H = 4, O = 3, Cu = 1. Vế phải: C = 4, H = 2, O = 5, Cu = 1.
– Bước 3: Chọn C để điều chỉnh hệ số.
– Bước 4: Đặt hệ số 2 cho CH3COOH để cân bằng C. Phương trình có dạng: 2CH3COOH + CuO → (CH3COO)2Cu + H2O
– Bước 5: Kiểm tra lại kết quả. Vế trái: C = 4, H = 8, O = 6, Cu = 1. Vế phải: C = 4, H = 2, O = 5, Cu = 1. Thấy rằng O và H chưa cân bằng.
– Bước 6: Chọn O để điều chỉnh hệ số tiếp theo.
– Bước 7: Đặt hệ số 2 cho H2O để cân bằng O. Phương trình có dạng: 2CH3COOH + CuO → (CH3COO)2Cu + 2H2O
– Bước 8: Kiểm tra lại kết quả. Vế trái: C = 4, H = 8, O = 6, Cu = 1. Vế phải: C = 4, H = 8, O = 6, Cu = 1. Thấy rằng tất cả các nguyên tố đều cân bằng.
Vậy phương trình đã cân bằng chính xác là:
2CH3COOH + CuO → (CH3COO)2Cu + 2H2O
2.6. Tính chất hóa học của Axit axetic:
Axit axetic CH3COOH (etanoic) là một axit hữu cơ, mạnh hơn axit cacbonic. Nó được tạo thành bằng việc liên kết nhóm methyl CH3 với cacboxyl COOH.
Nhôm thụ động với axit axetic do khi phản ứng, nó tạo ra lớp màng mỏng nhôm oxit trên bề mặt, ngăn chặn sự ăn mòn. Vì vậy, các nhà sản xuất vẫn thường dùng bình chứa bằng nhôm để đựng dung dịch này.
– Axit axetic tác dụng với oxit bazơ, bazơ tạo thành muối và nước.
CH3COOH + NaOH → CH3COONa + H2O
CH3COONa: (Natri axetat)
CH3COOH + CaO → (CH3COO)2Ca + H2O
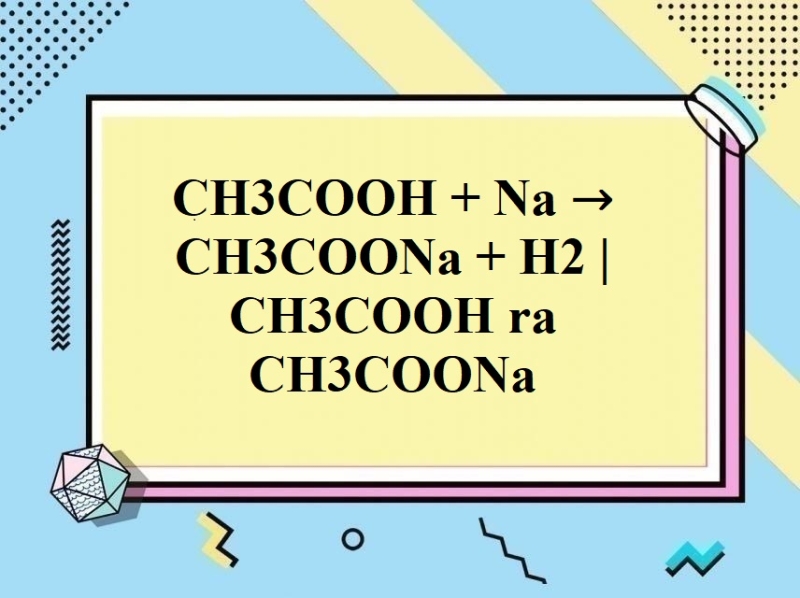
– Axit axetic tác dụng với kim loại (trước H) giải phóng H2:
2CH3COOH + 2Na → 2CH3COONa + H2↑
– Axit axetic tác dụng với muối của axit yếu hơn.
2CH3COOH + CaCO3 → (CH3COO)2C
– Phản ứng thế halogen vào gốc hydrocacbon ( 90 – 100oC):
Cl2 + CH3COOH → ClCH2COOH + HCl
– Axit axetic tác dụng với rượu tạo ra este và nước (xúc tác là H2SO4 đặc, nóng):
CH3COOH + HO-C2H5 →CH3COOC2H5 + H2O
3. Bài tập vận dụng liên quan và lời giải:
Câu 1: Dãy chất tác dụng với axit axit Axetic là
A. ZnO; Cu(OH)2; Cu; CuSO4; C2H5OH
B. CuO; Ba(OH)2; Zn; Na2CO3; C2H5OH
C. Ag; Cu(OH)2; ZnO; H2SO4; C2H5OH
D. H2SO4; Cu(OH)2; C2H5OH; C6H6; CaCO3
Câu 2: Axit axetic (CH3COOH) tác dụng được với tất cả các chất trong dãy nào sau đây?
A. Na, CuO, H2SO4
B. KOH, Na, BaCO3
C. KOH, Cu, NaCl
D. Na, NaCl, CuO
Câu 3: Trong các chất sau: axit axetic, glixerol, glucozơ, ancol etylic. Số chất hòa tan được Cu(OH)2 ở nhiệt độ thường là
A. 3
B. 2
C. 1
D. 4
Giải:
Câu 1:
Đáp án: B. CuO; Ba(OH)2; Zn; Na2CO3; C2H5OH
Câu 2:
Đáp án: B. KOH, Na, BaCO3
Ở đáp án A, axit axetic không tác dụng được với H2SO4 → Loại đáp án A
Ở đáp án C, axit axetic không tác dụng được với Cu (là kim loại sau H) → Loại đáp án C
Ở đáp án D, axit axetic không tác dụng được với NaCl → Loại đáp án D
Vậy Axit axetic (CH3COOH) tác dụng được với tất cả các chất trong dãy NaOH, Na, CaCO3
Phương trình hóa học
CH3COOH + NaOH → CH3COONa + H2O
CH3COOH + Na → CH3COONa + 1/2H2
2CH3COOH + BaCO3 → (CH3COO)2Ba + CO2 + H2O
Câu 3:
Đáp án: A. 3