Dưới đây là bài viết về phương trình hóa học CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O với những nội dung về cân bằng phương trình cùng những thông tin hữu ích về các chất trong phương trình, mời bạn đọc theo dõi.
Mục lục bài viết
- 1 1. Thông tin về phương trình hóa học CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O:
- 2 2. Cân bằng phương trình hóa học CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O:
- 3 3. Ứng dụng của phương trình hóa học CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O:
- 4 4. Bài tập liên quan đến phương trình hóa học CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O:
1. Thông tin về phương trình hóa học CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O:
1.1. CH3COOH là chất gì?
CH3COOH là công thức hóa học của Axit axetic và được biết đến với các tên khác, bao gồm axit ethanoic, axit etylic và axit metan cacboxylic.
Axit axetic được sản xuất chủ yếu bởi một nhóm vi khuẩn gram âm được gọi là vi khuẩn axit axetic (AAB). Chúng tạo ra axit axetic dưới dạng chất thải trao đổi chất từ quá trình lên men đường hoặc etanol . Cơ thể chúng ta cũng tạo ra một lượng nhỏ axit axetic, đóng vai trò quan trọng trong việc chuyển hóa carbs và chất béo.
Nhiều người nghĩ rằng axit axetic chính là giấm. Tuy nhiên, giấm thực sự chỉ là 4% đến 6% axit axetic hòa tan trong nước cùng với các tạp chất hữu cơ và vô cơ khác. Bên cạnh việc sử dụng ẩm thực nổi tiếng, axit axetic ở dạng nguyên chất còn có nhiều ứng dụng công nghiệp. Ví dụ, nó được sử dụng để sản xuất axetat kim loại, là một phần quan trọng của quy trình in.
Axit axetic có cấu tạo hóa học gồm hai nguyên tử cacbon, bốn hydro và hai nguyên tử oxy. Công thức hóa học của nó thường được viết là CH 3 COOH để chỉ các nhóm chức, đó là nhóm metyl (-CH3), nhóm hydroxyl (—OH) và nhóm cacbonyl (C=O).
Cacbon trong nhóm cacbonyl đóng vai trò là cacbon trung tâm mà các nhóm chức được gắn vào. Cũng giống như nhiều axit hữu cơ khác, axit axetic được xếp vào loại axit yếu. Điều này là do nó không phân ly hoàn toàn thành các ion khi hòa tan trong nước. Khi ở trong dung dịch nước, các ion của nó phân tách thành ion axetat tích điện âm (CH3COO–) và ion hydro tích điện dương (H+).
Axit axetic là một trong những loại axit cacboxylic đơn giản nhất, chỉ đứng sau axit formic. Về mặt công nghiệp, nó được sản xuất thông qua quá trình tổng hợp và lên men vi khuẩn. Quá trình lên men của vi khuẩn tuân theo con đường trao đổi chất tạo ra axit axetic từ glucose hoặc ethanol.
1.2. CaCO3 là chất gì?
Tên hóa học của CaCO3 là Canxi cacbonat.
Canxi cacbonat hoặc CaCO3 là một trong những hợp chất nổi tiếng nhất trong lĩnh vực hóa học. CaCO3 có thể được tìm thấy ở dạng tinh thể không màu hoặc dạng bột màu trắng, không mùi. Có một loạt các ứng dụng trong hóa học cũng như trong các lĩnh vực thương mại. Nó nằm trong lớp vỏ của hành tinh. Nó cũng có thể được tìm thấy trong nhiều loại vật liệu, bao gồm đá cẩm thạch, đá vôi, v.v. Trong bài viết này, chúng ta sẽ tìm hiểu thêm về CaCO3, Tính chất, cách điều chế, Phản ứng và cách sử dụng của nó.
Dạng nổi tiếng nhất của CaCO3 là đá vôi. Phấn, một loại CaCO3 rất phổ biến trong lớp học. Canxit, Vaterite và Aragonit là một vài ví dụ về khoáng chất canxi cacbonat tinh khiết. Vỏ ốc, vỏ trứng, vỏ hàu và các nguồn canxi cacbonat sinh học khác. Nó có thể được tìm thấy trong nhiều loại vật liệu, bao gồm đá cẩm thạch, đá vôi, v.v. Mặc dù có nhiều dạng khác nhau, nhưng chúng tương đương nhau về mặt hóa học và chỉ khác nhau về mặt vật lý.
Canxi cacbonat hoặc CaCO3 không có mùi. không độc hại và không tan trong nước, xuất hiện rộng rãi trong đá trên khắp hành tinh. Khoáng vật trắng CaCO3 là thành phần tự nhiên của đá phấn, đá vôi và đá cẩm thạch. Nó là một vật liệu điển hình được tìm thấy trong các khoáng chất canxit và aragonit trong đá.
CaCO 3 Khối lượng phân tử Tính: Oxi có khối lượng nguyên tử là 16u, cacbon có khối lượng nguyên tử là 12u, canxi có khối lượng nguyên tử là 40u,
Công thức của CaCO3 có ba nguyên tử Oxy, một canxi và một nguyên tử cacbon. Do đó tổng khối lượng phân tử của CaCO3 =(40+12+16×3)= 40+ 48+12= 100 g/mol
CaCO 3 có phân tử khối là 100 u hay 100 g/mol
CaCO3 có nhiều ứng dụng như sau:
– CaCO3 được sử dụng trong xây dựng các tòa nhà và đường xá vì aCaCO3 là một thành phần của xi măng.
– CaCO3 được sử dụng làm vật liệu xây dựng (đá hoa cương) trong ngành xây dựng.
– Nó được sử dụng trong ngành dược phẩm để sản xuất thuốc kháng axit từ các thành phần cơ bản.
– Thành phần chính của vôi nông nghiệp là canxi cacbonat, được tạo ra khi các ion canxi trong nước cứng kết hợp với các ion cacbonat để tạo thành cặn vôi.
– Nó được sử dụng trong y học để tinh chế sắt từ quặng sắt và như một chất bổ sung canxi hoặc thuốc kháng axit.
– Hầu hết các doanh nghiệp sử dụng giấy, sơn và bột giấy cũng sử dụng canxi cacbonat.
– Trong các cơ sở xử lý nước và nước thải, canxi cacbonat được sử dụng để loại bỏ các chất ô nhiễm và axit.
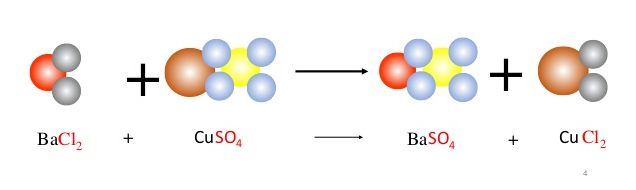
2. Cân bằng phương trình hóa học CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O:
CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O
Trước hết ta thấy ở phương trình bên trái có 3 phân tử C, 4 phân tử H, 5 phân tử O và 1 phân tử Ca; bên phải có 5 phân tử C, 8 phân tử H, 7 phân tử O và 1 phân tử Ca.
Cân bằng phương trình như sau:
2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O
3. Ứng dụng của phương trình hóa học CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O:
Để cung cấp thêm chi tiết về ứng dụng của phản ứng hóa học CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O, ta sẽ đi vào một số lĩnh vực cụ thể mà phản ứng này có ảnh hưởng:
– Ứng dụng trong ngành thực phẩm:
+ Canxi axetat ((CH3COO)2Ca) được sử dụng trong ngành công nghiệp thực phẩm để điều chỉnh độ axit và làm cho sản phẩm ổn định về pH.
+ Trong sản xuất pho mát, canxi axetat được sử dụng làm chất khử đông để đông đặc sữa.
+ Canxi axetat cũng có thể được sử dụng làm chất bảo quản tự nhiên trong các sản phẩm thực phẩm.
– Ứng dụng trong công nghiệp hóa chất:
+ Canxi axetat được sử dụng làm chất xúc tác trong một số quá trình hóa học.
+ Canxi axetat cũng có thể được sử dụng để tạo ra các hợp chất hữu cơ khác.
– Ứng dụng trong y học:
+ Trong y học, canxi axetat có thể được sử dụng như một chất điều trị cho một số vấn đề về sức khỏe như tăng tiết sữa sau sinh.
– Ứng dụng trong sản xuất nước giải khát:
+ Khí CO2 sản xuất từ phản ứng CH3COOH + CaCO3 được sử dụng để tạo ra nước giải khát có gas, đưa ra vị ngon và sảng khoái cho người tiêu dùng.
– Ứng dụng trong công nghiệp xi măng:
+ Trong sản xuất xi măng, khí CO2 được tạo ra từ phản ứng này có thể được sử dụng để kích hoạt quá trình lắng đọng xi măng từ pha hơi của chất nung.
– Các ứng dụng khác:
+ CO2 có thể được sử dụng làm khí bay trong các ống thổi làm sạch máy móc.
+ Trong lĩnh vực trồng cây, CO2 được sử dụng để tăng năng suất và chất lượng cây trồng trong các trang trại thủy canh và nhà kính.
Điều quan trọng là phản ứng CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O tạo ra các sản phẩm có nhiều ứng dụng khác nhau trong nhiều lĩnh vực công nghiệp và đời sống hàng ngày của con người. Nó giúp cải thiện chất lượng và giá trị của các sản phẩm và đồng thời có ảnh hưởng đáng kể đến sự phát triển của nền kinh tế và xã hội.
4. Bài tập liên quan đến phương trình hóa học CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O:
Dưới đây là một số bài tập liên quan đến tính chất hóa học và vật lý của các chất trong phương trình hóa học CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O. Hãy xem xét và trả lời các câu hỏi liên quan:
Bài tập 1: Tính chất hóa học của axit axetic (CH3COOH)
a) Điều gì xảy ra khi axit axetic tiếp xúc với da và mắt? b) Tại sao axit axetic được coi là một axit yếu?
Bài tập 2: Tính chất vật lý của canxi cacbonat (CaCO3)
a) Canxi cacbonat tồn tại dưới dạng gì trong tự nhiên? b) Khi canxi cacbonat bị đun nóng, nó sẽ phân hủy thành những chất gì và phát tán khí gì?
Bài tập 3: Tính chất hóa học của canxi axetat ((CH3COO)2Ca)
a) Canxi axetat có mùi và vị như thế nào? b) Canxi axetat có phản ứng với nước không? Nếu có, hãy viết phương trình phản ứng.
Bài tập 4: Tính chất vật lý và hóa học của khí CO2
a) Khí CO2 có màu gì và không mùi. b) Điều gì xảy ra khi khí CO2 được thổi vào nước vôi trong dư? c) Tại sao khí CO2 được xem là một khí nhà kính?
Bài tập 5: Tính chất vật lý và hóa học của nước (H2O)
a) Tính năng nào của nước làm cho nó trở thành chất sống cần thiết cho các hệ sinh thái? b) Nước là dung dịch phân ly yếu. Hãy viết phương trình phân ly của nước.
Đáp án:
Bài tập 1: a) Axit axetic là một chất ăn mòn và gây kích ứng nghiêm trọng khi tiếp xúc với da và mắt. b) Axit axetic được coi là một axit yếu vì nó phân li trong nước thành ít ion H+.
Bài tập 2: a) Canxi cacbonat tồn tại dưới dạng khoáng vật vôi trong tự nhiên. b) Khi canxi cacbonat bị đun nóng, nó phân hủy thành canxi oxit (CaO) và khí CO2.
Bài tập 3: a) Canxi axetat có mùi giống như giấm và có vị chua. b) Canxi axetat không phản ứng với nước.
Bài tập 4: a) Khí CO2 không màu và không mùi. b) Khi khí CO2 được thổi vào nước vôi trong dư, nước vôi sẽ trở nên mờ và kết tủa canxi cacbonat (CaCO3). c) Khí CO2 được xem là một khí nhà kính vì nó giữ lại nhiệt độ trên bề mặt trái đất, góp phần vào hiệu ứng nhà kính và biến đổi khí hậu.
Bài tập 5: a) Tính năng nước làm cho nó trở thành chất sống cần thiết cho các hệ sinh thái bao gồm khả năng tạo môi trường sống, giúp vận chuyển chất dinh dưỡng và chất thải, và tham gia vào quá trình quang hợp. b) Phân ly của nước: 2H2O(l) ⇌ H3O+(aq) + OH-(aq).