Mục lục bài viết
1. Phương trình phản ứng Ca(OH)2 + HCl
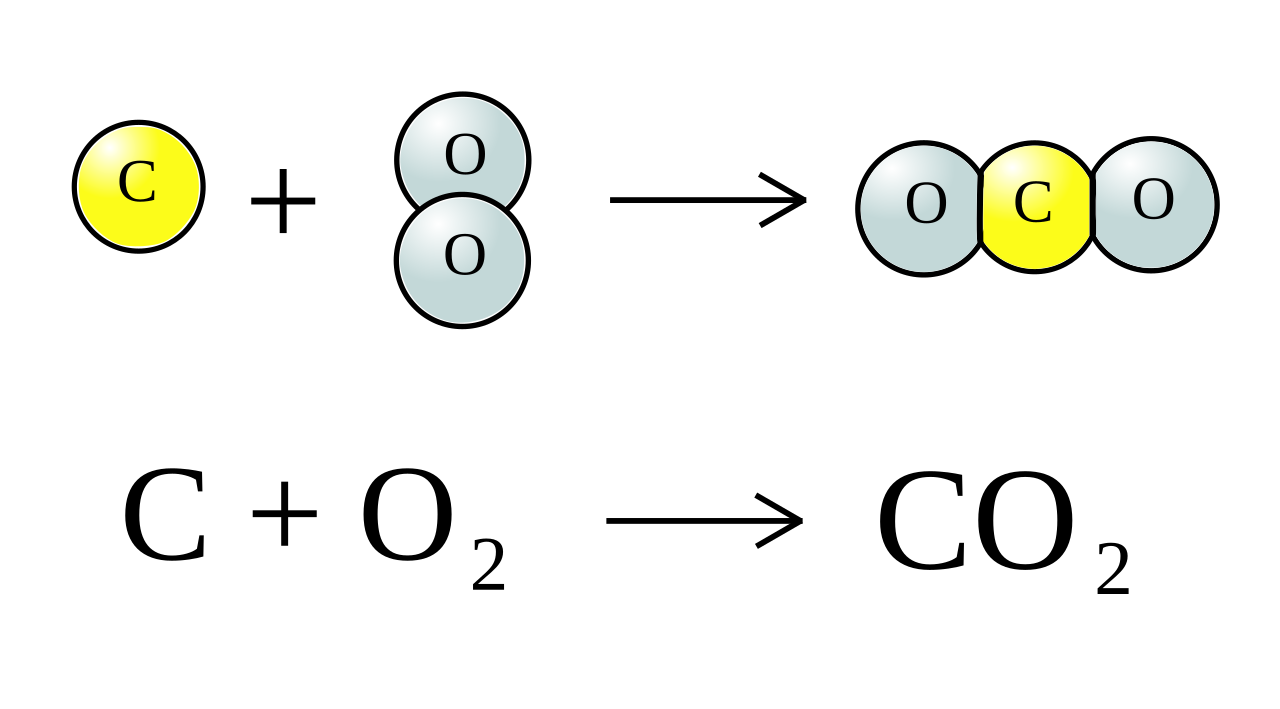
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
– Điều kiện xảy ra của phản ứng Ca(OH)2 tác dụng HCl: xảy ra phản ứng ở nhiệt độ thường
– Cách thực hiện phản ứng Ca(OH)2 + HCl:
+ Cho dung dịch CaOH2 tác dụng với dung dịch axit HCl
– Hiện tượng nhận biết phản ứng Ca(OH)2 + HCl
+ Canxi hidroxit tác dụng với axit clohiđric tạo thành muối canxi clorua và nước.
2. Một số điều cần biết về Ca(OH)2:
2.1. Khái niệm:
Ca(OH)2 hay còn gọi là vôi tôi hay vôi sống, là một loại hóa chất thông dụng trong đời sống hàng ngày cũng như trong sản xuất công nghiệp.
Canxi hydroxit Ca(OH)2 là chất kết tinh không màu hoặc dạng bột trắng, do đó được sử dụng khi phản ứng với Canxi oxit (CaO, tức là sống) với nước (gọi là quá trình dập tắt). Nó cũng có thể kết thúc khi trộn dung dịch chứa canxi clorua (CaCl2) với dung dịch chứa natri hydroxit (NaOH).
– Vôi tôi có 2 dạng phổ biến:
+ Dạng vôi sữa:là dung dịch Ca(OH)2 không thể ủ được bao gồm các hạt canxi hydroxit rất mịn trong nước.
+ Nước vôi trong: Dung dịch Ca(OH)2 sau khi loại bỏ lớp ngăn rắn thu được dung dịch trong suốt
2.2. Tính chất vật lý của Ca(OH)2:
Ca(OH)2 là chất rắn màu trắng, ít tan trong nước. Khi hòa tan tạo thành dung dịch canxi hiđroxit.
Trong tự nhiên, Ca(OH)2 tồn tại ở dạng xúc tác gọi là portlandit.
Ca(OH)2 Không mùi, dễ cháy.
Điểm nóng chảy là 580 độ C (853 K).
Phân tử gam là 74,093 g/mol.
2.3. Tính chất hóa học của ca(oh)2:
Dung dịch canxi hiđroxit có tính bazơ mạnh. Có tất cả các thuộc tính của một cơ sở điển hình:
– Thay đổi màu của chỉ thị màu
Canxi hiđroxit làm giấy quỳ tím chuyển sang màu xanh và dung dịch phenolphtalein từ không màu chuyển sang màu hồng.
Ca(OH)2 tác dụng với axit tạo thành muối và nước
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
– Tác dụng với oxit axit tạo muối và nước
3Ca(OH)2 + P2O5 → Ca3(PO4)2↓ + 3H2O
Riêng đối với trường hợp CO2
Khi sục khí CO2 dư vào dung dịch Ca(OH)2 thì
Dịch vụ sơn mờ ban đầu:
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Sau đó, kết quả dần dần tách biệt và sử dụng các dịch vụ minh bạch:
CO2 + H2O + CaCO3 → Ca(HCO3)2
– Tác động với ánh sáng để tạo thành ánh sáng mới và cơ sở mới
Ca(OH)2 + Na2CO3 → CaCO3↓ + 2NaOH
2.4. Điều chế vôi tôi Ca(OH)2:
Cách phổ biến và thông dụng nhất được sử dụng để kiểm soát Vôi tôi có thể làm như sau:
Đầu tiên, Đá vôi (CaCO3) được đưa vào lò nung để tạo thành than sống (CaO)
PTP
CaCO3 → CaO + CO2 (Nhiệt độ cao)
Sau đó, Thả (CaO) sống vào nước ta được Ca(OH)2.
PTP
CaO + H2O → Ca(OH)2.
2.5. Ứng dụng quan trọng nhất của ca(oh)2:
-Thứ nhất, Ca(OH)2 là hóa chất quan trọng dùng để xử lý nước:
Dịch vụ vận hành xử lý nước thải uy tín – Bảo trì hệ thống
Do tính chất hóa học đặc thù là phản ứng với axit và ăn mòn nhiều kim loại có trong nước nên tôi có thể kết hợp các tạp chất trong nước và xử lý nước thải. Đất chua chứa nhiều axit nhưng người ta thường sử dụng canxi hiđroxit để khử axit trong đất, trung hòa độ pH của đất, hơn nữa giá thành tương đối rẻ nên tiết kiệm điện và quan trọng nhất là ít gây hư hỏng. hại nhất cho con người.
Ca(OH)2 được dùng làm chất keo tụ, do tính chất của canxi hiđroxit, nó có thể phản ứng với axit, ăn mòn một số kim loại trong nước, đóng vai trò là chất keo tụ để xử lý nước, làm sạch, giúp làm sạch nước. Loại bỏ vi khuẩn và sinh vật, trung hòa mùi hôi, hoạt động như một chất keo tụ để xử lý nước
– Thứ hai, Ca(OH)2 là nguyên liệu rất quan trọng cho các ngành công nghiệp.
+ công nghiệp hóa chất
Ca(OH)2 được coi là chất trung gian để sản xuất một số hóa chất:
Ca(OH)2 Tác dụng với axit HCl tạo CaCl2
Ca(OH)2 Phản ứng với các oxit bazơ như CO2 để tạo ra CaCO3 dùng trong công nghiệp
Ca(OH)2 Phản ứng với CuCl2 tạo ra hóa chất Cu(OH)2 trong ngành công nghiệp tàu biển.
Canxi hydroxit được dùng để loại bỏ Canxi cacbonat và Magiê cacbonat ra khỏi nước biển trong sản xuất muối ăn và muối y tế.
+ Công nghiệp lọc dầu
nhà máy dầu
Canxi hydroxit được sử dụng trong lọc dầu để kết hợp và loại bỏ các tạp chất trong dầu, tạo ra dầu sạch, tinh khiết không lẫn tạp chất.
– Thứ ba, Ca(OH)2 là hóa chất được sử dụng rộng rãi trong nông nghiệp.
Đất nông nghiệp bị nhiễm phèn (chủ yếu tồn dư chua) dẫn đến đất chua. Nhờ có canxi hiđroxit có tính bazơ mạnh, nó được dùng để hạ và trung hòa độ pH, giúp khử độc và khử chua cho đất, cải tạo đất chua, nhiều thách thức và còn là thành phần của một số hóa chất nông nghiệp. , thuốc trừ sâu độc hại khác.
Ngoài ra, Ca(OH)2 còn được dùng làm chất bảo quản thực phẩm, sản xuất thuốc Polikar bảo quản rau, củ, quả tránh nấm cháy, thối.
– Thứ tư, Ca(OH)2 là nguyên liệu của ngành xây dựng
Ca(OH)2 là thành phần quan trọng để tạo ra hỗn hợp kết tủa, xỉn màu của các hàng gạch cũng như bột trét tường. Sở dĩ canxi hydroxit được sử dụng là do hỗn hợp và nước khá dẻo như hồ, khả năng kết hợp rất tốt. Khi để ngoài không khí chúng ta sẽ khô lại nhưng hơi nước tồn tại trong không khí khá chậm.
– Thứ năm, Ca(OH)2 được ứng dụng rộng rãi trong y học
Canxi hiđroxit Ca(OH)2 là thành phần có trong một số loại thuốc dùng trong y tế. Ngoài ra, nó còn được dùng để sản xuất một số loại dầu dưỡng tóc quá rụng. Ở dạng bột nhão, canxi hydroxit được sử dụng trong nha khoa như một chất chống sâu răng.
– Thứ sáu, Ca(OH)2 được sử dụng trong ngành da thuộc, lượng axit chứa trong da thuộc khá nhiều nên cần sử dụng Ca(OH)2 để trung hòa lượng axit đó.
– Thứ bảy, Ca(OH)2 còn được dùng để khử độc chất thải công nghiệp, khử trùng hoặc có thể dùng để điều trị sâu răng.
– Thứ tám, Ca(OH)2 được coi là chất trung gian để sản xuất một số hóa chất như để tạo ra hóa chất CaCl2, CaCO3, Cu(OH)2,..
3. Bài tập vận dụng liên quan:
Câu 1. Dung dịch Ca(OH)2 phản ứng với dãy oxit:
A. CO2; SO2; P2O5; Fe2O3
B. Fe2O3; SO2; SO3; MgO
C. P2O5; CO2; Al2O3; SO3
D. P2O5; CO2; CuO; SO3
Xem đáp án
Câu 2. Dãy các bazơ bị nhiệt phân huỷ tạo thành oxit bazơ tương ứng và nước:
A. Cu(OH)2; Zn(OH)2; Al(OH)3; Mg(OH)2
B. Cu(OH)2; Zn(OH)2; Al(OH)3; KOH
C. Fe(OH)3; Cu(OH)2; KOH; Mg(OH)2
D. Fe(OH)3; Cu(OH)2; Ca(OH)2; Mg(OH)2
Câu 3. Chất nào dưới đây tác dụng được với cả dung dịch NaOH và dung dịch HCl
A. Al
B. Fe
C. Cu
D. Zn
Xem đáp án
Câu 4. Dung dịch làm phenolphtalein không màu thành màu hồng là:
A. H2SO4
B. KCl
C. Ca(OH)2
D. Na2SO4
Xem đáp án
4. Một số biện pháp sơ cứu khi tiếp xúc vôi tôi Ca(OH)2 :
Trong quá trình sử dụng nếu tiếp xúc trực tiếp với mình cần thực hiện các biện pháp sơ cứu y tế phù hợp, cụ thể như sau:
Tiếp xúc với mắt: Ngay lập tức dùng nước để làm sạch mắt và chớp mắt trong khi rửa ít nhất 15 phút. Nếu sau 15 phút mà mắt vẫn chưa trở lại bình thường thì cần nhanh chóng đến cơ sở y tế gần nhất để được thăm khám và điều trị kịp thời.
Tiếp xúc ngoài da: Nhanh chóng cởi bỏ mặc định quần áo đã được tẩy hóa chất, sau đó dùng nước rửa sạch nhiều lần nơi bị bắn vào da và nên kết hợp với xà phòng. Tuy nhiên, nếu trường hợp nghiêm trọng hơn thì cần đưa ngay đến cơ sở y tế gần nhất để điều chỉnh thời gian.
Tiếp xúc với đường tiêu hóa: Nếu bị lẫn hoặc phải làm mềm, không được gây khó chịu mà phải cho nạn nhân uống nhiều nước. Nếu nạn nhân còn thở, hãy để đầu nạn nhân cao hơn hông và tránh để khí độc thoát ra ngoài. Nếu nạn nhân xảy ra ở tỉnh nào thì không để xảy ra sự cố gì cho nạn nhân và việc nới lỏng quần áo như cởi bỏ dây buộc, thắt lưng và đưa nạn nhân đến cơ sở y tế gần đó để được điều trị kịp thời.
Tiếp xúc qua đường hô hấp: Nhanh chóng di chuyển nạn nhân đến nơi thoáng khí, giữ cho đầu nạn nhân thoải mái để thở. Trường hợp nạn nhân không còn thở cần tiến hành các biện pháp sơ cứu như hô hấp nhân tạo và đưa nạn nhân đến cơ sở y tế gần nhất khi nạn nhân đã ổn định hơn.
*Xử lí trường hợp đổ, rò rỉ vôi tôi:
Nếu tỷ lệ rò rỉ nhỏ; Tiến hành sử dụng các công cụ phù hợp để chuyển chỗ rò rỉ của tôi sang các thùng chứa chất thải. Ngoài ra, bạn có thể dùng thêm axit axetic để trung hòa lượng hóa chất còn sót lại và dùng nước sạch rửa nhiều lần khu vực bị tràn.
Nếu mức độ rò rỉ, rò rỉ lớn: Nhanh chóng dùng nước xịt vào. Hạn chế tối đa lượng hơi, chặn hóa chất tràn đổ vào hệ thống nước, đường cống thoát nước… Sau đó thu gom lượng hóa chất có trong thùng rác chuyên dụng thùng chứa và liên hệ với chính quyền địa phương nếu lượng hóa chất thoát ra quá lớn không thể xử lý. Dùng nước sạch để làm sạch hóa chất bị tràn ra ngoài.