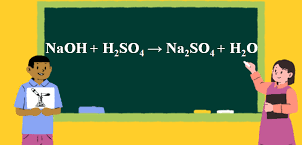
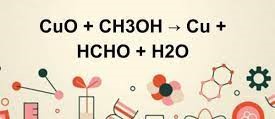
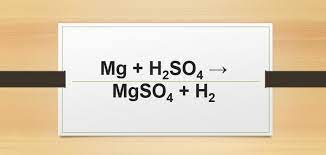
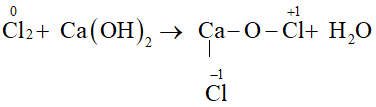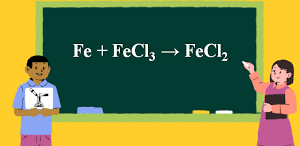Phản ứng cân bằng được thể hiện bằng phương trình: MnO2 + HCl → MnCl2 + Cl2 + H2O. Qua phản ứng này, chúng ta có thể thấy sự chuyển đổi và tạo ra các chất mới từ các chất ban đầu. Phản ứng này có thể được sử dụng trong nhiều ứng dụng khác nhau, ví dụ như trong công nghiệp hoá chất và công nghệ môi trường.
Mục lục bài viết
1. Cân bằng phương trình MnO2 + HCl → MnCl2 + Cl2 + H2O:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
2. Điều kiện để phản ứng MnO2 ra Cl2:
Điều kiện cần thiết để phản ứng MnO2 thành Cl2 là nhiệt độ. Ngoài ra, còn có một số yếu tố khác có thể ảnh hưởng đến quá trình phản ứng như áp suất, nồng độ chất xúc tác và thời gian phản ứng. Tuy nhiên, nhiệt độ được xem là yếu tố quan trọng nhất để đạt được hiệu suất phản ứng tốt nhất. Việc tăng nhiệt độ sẽ tăng khả năng phản ứng của MnO2, làm tăng sản phẩm Cl2 được tạo ra. Do đó, để đảm bảo hiệu suất phản ứng cao, nhiệt độ cần được kiểm soát và điều chỉnh phù hợp.
3. Bản chất của các chất tham gia phản ứng:
Bản chất của MnO2 (Mangan dioxit)
MnO2, hay còn được gọi là Mangan dioxit, là một chất không màu và có khả năng tác dụng như một chất oxi hóa trong phản ứng hóa học.
Trong phản ứng trên, MnO2 chủ yếu tham gia vào quá trình oxi hóa, giúp chuyển đổi các chất khác thành dạng oxit.
Một điểm đáng chú ý là khi MnO2 tan trong dung dịch axit, nó không chỉ tạo ra muối kém bền của Mn+4 theo phản ứng trao đổi, mà còn tác động như một chất oxi hóa, tăng cường sự oxi hóa của các chất khác trong phản ứng.
Bản chất của HCl (Axit clohidric)
HCl, còn được biết đến với tên gọi Axit clohidric, là một axit mạnh và có khả năng tác dụng với oxit trong phản ứng hóa học.
Trong phản ứng trên, HCl là chất khử, giúp giảm mức oxi hóa của các chất khác trong quá trình phản ứng.
Đặc biệt, HCl có khả năng tác dụng với các dạng oxit, tạo ra các muối và nước, thường gây ra những phản ứng hóa học quan trọng và có ứng dụng rộng trong ngành công nghiệp và nghiên cứu khoa học.
4. Điều chế Clo trong phòng thí nghiệm bằng cách nào?
Để điều chế Clo trong phòng thí nghiệm, người ta thường sử dụng axit clohydric đặc để tác dụng với một chất oxi hóa mạnh như mangan dioxit hoặc kali penmanganat. Khi sử dụng mangan dioxit, cần có xúc tác nhiệt độ còn và khi sử dụng kali penmanganat, có thể đun hoặc không đun nóng. Quá trình này giúp tạo ra khí Clo.
Mangan dioxit (MnO2) là một chất oxi hóa mạnh có khả năng oxi hóa axit clohydric (HCl) thành mangan clorua (MnCl2), khí Clo (Cl2) và nước (H2O) theo công thức phản ứng sau: MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O. Trong quá trình này, mangan dioxit chịu tác động của nhiệt độ và xúc tác để tạo ra các sản phẩm phản ứng.
Tương tự, khi sử dụng kali penmanganat (KMnO4), cũng có thể điều chế được khí Clo. Kali penmanganat cũng là một chất oxi hóa mạnh, có khả năng oxi hóa axit clohydric thành kali clorua (KCl), mangan clorua (MnCl2), khí Clo (Cl2) và nước (H2O) theo công thức phản ứng sau: 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 6H2O. Việc đun nóng hoặc không đun nóng khi tác dụng kali penmanganat với axit clohydric phụ thuộc vào điều kiện thực hiện.
Tuy nhiên, khi điều chế khí Clo trong phòng thí nghiệm, khí Clo thu được thường bị lẫn tạp chất như khí hiđro clorua (HCl) và hơi nước (H2O). Để loại bỏ tạp chất và thu được khí Clo nguyên chất, người thực hiện sẽ dẫn khí qua các bình rửa khí. Trong đó, dung dịch NaCl được sử dụng để giữ lại HCl, còn dung dịch H2SO4 đặc được sử dụng để giữ lại hơi nước. Quá trình này giúp tạo ra khí Clo tinh khiết trng phòng thí nghiệm.
Ngoài ra, trong công nghiệp, khí Clo cũng có thể được điều chế bằng cách điện phân nóng chảy muối Natri clorua (NaCl) theo phản ứng: 2NaCl → 2Na + Cl2. Điện phân nóng chảy muối NaCl tạo ra natri (Na) và khí Clo (Cl2). Hoặc có thể điện phân dung dịch muối có màng ngăn theo phản ứng: 2NaCl + 2H2O → H2+ 2NaOH + Cl2. Trong phản ứng này, nước (H2O) được chia thành khí hiđro (H2), natri hidroxit (NaOH) và khí Clo (Cl2) được tạo ra.
Với các phương pháp điều chế Clo trên, ta có thể đạt được khí Clo nguyên chất để sử dụng trong nhiều ứng dụng khác nhau. Khí Clo được sử dụng rộng rãi trong công nghiệp hóa chất, như sản xuất chất tẩy và khử trùng. Nó cũng được sử dụng trong xử lý nước để tiêu diệt vi khuẩn và các tác nhân gây bệnh. Khí Clo cũng có thể được sử dụng trong quá trình làm trắng chất liệu, sản xuất chất oxy hóa và trong nhiều lĩnh vực khác.
5. Tính chất hoá học của axit clohidric (HCl):
Dung dịch axit clohidric (HCl) là một trong những chất quan trọng và phổ biến nhất trong hóa học. Nó có những tính chất hoá học đặc trưng và đa dạng, đóng vai trò quan trọng trong nhiều quá trình và ứng dụng.
Tác dụng với chất chỉ thị
Một trong những cách đơn giản để nhận biết axit clohidric là thông qua tác dụng của nó với chất chỉ thị. Dung dịch axit HCl có khả năng làm quì tím hoá đỏ. Khi HCl tác dụng với nước, nó phân ly thành ion hidro (H+) và ion clo (Cl-):
HCl → H+ + Cl-
Tác dụng với kim loại
Tính chất tác dụng của axit clohidric với kim loại là một trong những tính chất quan trọng và được nghiên cứu rất kỹ trong hóa học. Axit clohidric tác dụng với một số kim loại, đặc biệt là các kim loại có hóa trị thấp. Khi tác dụng với các kim loại như sắt (Fe) và nhôm (Al), HCl tạo ra muối tương ứng và giải phóng khí hidro (H2). Đây là cách để thể hiện tính oxi hóa của axit.
Ví dụ:
Fe + 2HCl → FeCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
Tuy nhiên, không phải tất cả các kim loại đều tác dụng với HCl. Ví dụ, đồng (Cu) không tác dụng với axit clohidric.
Cu + HCl → không có phản ứng
Tác dụng với các hợp chất khác
Ngoài tác dụng với kim loại, axit clohidric cũng tác dụng được với nhiều loại hợp chất khác nhau. Ví dụ, nó có khả năng tác dụng với các bazơ để tạo ra muối và nước. Ngoài ra, HCl cũng có thể tác dụng với các hợp chất hữu cơ, tạo ra các sản phẩm phản ứng đa dạng.
Ứng dụng
Axit clohidric có nhiều ứng dụng quan trọng trong kỹ thuật và công nghiệp. Nó được sử dụng làm chất phân tích trong phòng thí nghiệm, trong sản xuất muối, axit và các hợp chất clo. Ngoài ra, HCl còn được sử dụng trong quá trình tẩy trắng và làm sạch, sản xuất thuốc nhuộm và trong quá trình sản xuất thực phẩm.
Với những tính chất và ứng dụng đa dạng như vậy, axit clohidric (HCl) là một chất quan trọng không thể thiếu trong lĩnh vực hóa học và công nghiệp.
Tác dụng với oxit bazo và bazo
Trong hóa học, axit clohidric (HCl) là một chất axit mạnh và có nhiều tác dụng quan trọng với các oxit bazo và bazo. Khi tác dụng với oxit bazo hoặc bazo, HCl tạo ra sản phẩm là muối và nước.
Ví dụ:
Phản ứng giữa natri hydroxit (NaOH) và HCl: NaOH + HCl → NaCl + H2O
Phản ứng giữa đồng oxit (CuO) và HCl: CuO + 2HCl → CuCl2 + H2O
Phản ứng giữa oxit sắt (Fe2O3) và HCl: Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Tác dụng với muối (theo điều kiện phản ứng trao đổi)
Axit clohidric cũng có khả năng tác dụng với muối trong điều kiện phản ứng trao đổi, tạo ra các sản phẩm gồm muối, nước và khí CO2 thoát ra. Điều này cho phép nhận biết gốc clorua trong chất.
Ví dụ:
Phản ứng giữa canxi cacbonat (CaCO3) và HCl: CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
Phản ứng giữa nitrat bạc (AgNO3) và HCl: AgNO3 + HCl → AgCl↓ + HNO3 (dùng để nhận biết gốc clorua)
Bên cạnh tính chất axit, dung dịch axit HCl đặc còn có khả năng hoạt động như một chất khử khi tác dụng với các chất oxi hoá mạnh như KMnO4, MnO2, K2Cr2O7, MnO2, KClO3…
Ví dụ:
Phản ứng giữa 4HCl và mangan dioxit (MnO2): 4HCl + MnO2 → MnCl2 + Cl + 2H2O
Phản ứng giữa kali dichromat (K2Cr2O7) và 14HCl: K2Cr2O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2O
Ngoài ra, hỗn hợp gồm 3 thể tích axit clohidric và 1 thể tích axit nitric đặc được gọi là hỗn hợp nước cường toan (cường thuỷ). Hỗn hợp này có khả năng hoà tan được vàng (Au), tạo ra muối và các sản phẩm phụ khác.
Ví dụ:
Phản ứng giữa 3HCl và HNO3: 3HCl + HNO3 → 2Cl + NOCl + 2H2O
Phản ứng giữa NOCl: NOCl → NO + Cl
Phản ứng giữa vàng (Au) và 3Cl: Au + 3Cl → AuCl3