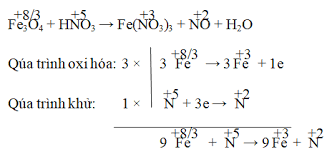Để cân bằng phương trình hóa học NH3 + O2 → NO + H2O bạn cần điều chỉnh số lượng các phân tử của các chất tham gia và sản phẩm để đảm bảo số lượng nguyên tố và điện tích trên cả hai bên của phương trình bằng nhau. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng. Mời các bạn đón xem:
Mục lục bài viết
1. Cân bằng phương trình hóa học: NH3 + O2 → NO + H2O:
Bằng cách này, chúng ta đã đảm bảo rằng có 4 nguyên tử nitơ, 12 nguyên tử hydrogen và 10 nguyên tử oxy ở cả hai bên của mũi tên, đảm bảo rằng phản ứng diễn ra một cách đầy đủ và cân bằng. Cân bằng phương trình hóa học là quá trình quan trọng để hiểu và áp dụng trong nghiên cứu và ứng dụng hóa học thực tế.
Điều kiện phản ứng NH3 ra NO
Nhiệt độ: 850 – 900oC
Xúc tác: Pt (hoặc Fe2O3, Cr2O3).
Cách cân bằng phản ứng NH3 ra NO
Bắt đầu với amoniac (), chúng ta có một nguyên tử nitơ (N) và ba nguyên tử hydro (H). Trên bên kia, khí nitơ () có một nguyên tử nitơ và một nguyên tử oxy (O), và nước () chứa hai nguyên tử hydrogen và một nguyên tử oxy.
Khi xem xét khí oxi (), chúng ta thấy có hai nguyên tử oxy. Để cân bằng số lượng oxy ở cả hai bên của phản ứng, chúng ta có thể điều chỉnh hệ số trước các chất để làm cho số nguyên tử oxy bằng nhau.
2. Tìm hiểu về NH3:
2.1. Tính chất vật lí:
Amoniac, hay NH3, là một phân tử không gian với công thức hóa học biểu diễn cho một nguyên tử nitơ (N) kết hợp với ba nguyên tử hydro (H). Tính chất vật lý của NH3 được định đặc biệt bởi cấu trúc phân tử của nó và tương tác giữa các phân tử. Dưới đây là một số đặc điểm quan trọng về tính chất vật lý của NH3:
– Kiểu dáng phân tử: NH3 có hình dạng hình nón tam giác không gian do có một nguyên tử nitơ ở trung tâm và ba nguyên tử hydro xung quanh theo góc 107,3 độ. Điều này tạo ra một phân tử không gian, có những tương tác đặc biệt trong các quá trình hóa học và tương tác với các chất khác.
– Điện tích hóa học: Amoniac là một phân tử có tính chất bazơ, nghĩa là nó có khả năng nhận một proton để tạo ra ion amoni (NH4+). Điều này là do nguyên tử nitơ trong phân tử có một cặp electron không liên kết (lone pair), làm cho nó có khả năng chất xúc tác và tương tác với các chất axit.
– Điểm sôi và điểm đóng đặc: Amoniac có điểm sôi tại -33,34 độ C và điểm đóng đặc là -77,7 độ C. Điều này làm cho nó trạng thái khí ở điều kiện tiêu chuẩn, tuy nhiên, ở nhiệt độ thấp hơn, nó có thể tồn tại dưới dạng chất lỏng hoặc chất rắn.
– Khả năng hòa tan: Amoniac có khả năng hòa tan tốt trong nước, tạo thành dung dịch amoni (NH4OH). Điều này là do tính chất bazơ của amoniac, khi nó tương tác với nước để tạo ra các ion amoni và hydroxide.
– Khối lượng riêng: Khối lượng riêng của amoniac là khoảng 0,771 kg/L ở điều kiện tiêu chuẩn. Điều này làm cho nó nhẹ hơn không khí, và do đó nó có thể nổi lên trong không khí.
– Mùi đặc trưng: Amoniac có một mùi đặc trưng, khá khó chịu và mạnh mẽ. Điều này làm cho nó dễ nhận biết và thường được sử dụng trong các ứng dụng như làm lạnh, sản xuất phân bón, và trong ngành công nghiệp hóa chất.
Tính chất vật lý của NH3 làm cho nó trở thành một chất quan trọng trong nhiều lĩnh vực, từ công nghiệp đến nông nghiệp và hóa học. Sự hiểu biết về các tính chất này là quan trọng để áp dụng amoniac một cách an toàn và hiệu quả trong các ứng dụng khác nhau.
2.2. Tính chất hoá học:
Amoniac, có công thức hóa học NH3, không chỉ có những tính chất vật lý đặc trưng mà còn nổi bật với những tính chất hoá học quan trọng. Dưới đây là một số đặc điểm quan trọng về tính chất hoá học của NH3:
– Tính Bazơ: Amoniac thường được biết đến với tính chất bazơ mạnh. Nó có khả năng nhận proton để tạo thành ion amoni (NH4+) trong các phản ứng hóa học. Sự hiện diện của một cặp electron không liên kết (lone pair) trên nguyên tử nitơ làm cho amoniac trở thành một chất phản ứng tốt với các axit, tạo thành muối amoni.
– Phản ứng với axit: Amoniac tương tác mạnh mẽ với các axit để tạo ra các muối amoni. Ví dụ, khi trộn amoniac với axit hydrochloric (HCl), ta thu được muối amoni clorua (NH4Cl). Phản ứng này là cơ sở cho việc sử dụng amoniac trong sản xuất phân bón và trong các quá trình tạo ra các hợp chất amoni.
– Phản ứng với oxit: Amoniac cũng có khả năng tương tác với các oxit để tạo ra các hợp chất nitrat và nitrit. Chẳng hạn, khi amoniac phản ứng với oxi, ta có thể tạo ra nitric oxide (NO) hoặc nitrous oxide (N2O), những chất có ứng dụng trong ngành công nghiệp và y học.
– Phản ứng với ion kim loại: Amoniac cũng có khả năng tương tác với các ion kim loại để tạo ra các phức chất amoni kim loại. Ví dụ, khi amoniac tác động với ion đồng (II) Cu^2+, ta thu được phức chất amoni đồng (II) (Cu(NH3)4^2+).
– Phản ứng tạo muối amoni: Sự tương tác giữa amoniac và các axit có thể tạo ra nhiều loại muối amoni khác nhau, tùy thuộc vào loại axit tham gia vào phản ứng.
Những tính chất hoá học của NH3 làm cho nó trở thành một chất quan trọng trong nhiều lĩnh vực, từ sản xuất hóa chất đến nông nghiệp và y học. Sự linh hoạt trong các phản ứng và khả năng tương tác với nhiều chất khác nhau làm cho amoniac trở thành một yếu tố quan trọng trong các quá trình sản xuất và phản ứng hóa học.