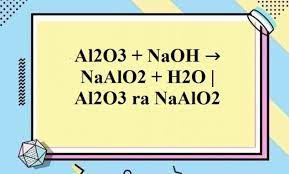
Fe + FeCl3 → FeCl2 được chúng tôi biên soạn hướng dẫn các bạn học sinh viết phương trình phản ứng Fe tác dụng với FeCl3, sau phản ứng thu được FeCl2. Từ đó vận dụng giải các dạng câu hỏi bài tập liên quan đến sắt.
Mục lục bài viết
1. Cân bằng phương trình hóa học: Fe + FeCl3 → FeCl2:
Fe + 2FeCl3 → 3FeCl2
Điều kiện của phản ứng Fe tác dụng với FeCl3: Phản ứng diễn ra ở ngay điều kiện thường.
Hiện tượng của phản ứng Fe tác dụng với FeCl3: Sắt (Fe) tan dần, dung dịch chuyển từ màu vàng nâu sang màu xanh rêu.
Vai trò của các chất trong phản ứng Fe tác dụng với FeCl3
Fe0+2Fe+3Cl3→3Fe+2Cl2″>
Phản ứng Fe tác dụng với FeCl3 thuộc loại phản ứng oxi hoá khử.
Trong đó Fe là chất khử; FeCl3 là chất oxi hoá.
2. Mở rộng kiến thức về sắt (Fe):
2.1. Vị trí trong bảng tuần hoàn và cấu hình electron nguyên tử:
– Sắt (Fe) thuộc ô 26, chu kì 4, nhóm VIIIB của bảng tuần hoàn.
– Cấu hình electron nguyên tử: 1s22s22p63s23p63d64s2 có thể viết gọn là [Ar]3d64s2.
Nguyên tử sắt dễ dàng nhường 2e ở phân lớp 4s trở thành ion Fe2+ và có thể nhường thêm 1e ở phân lớp 3d trở thành Fe3+.