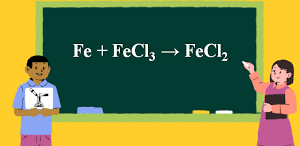Cân bằng phản ứng: Zn + HNO3 → Zn(NO3)2 + N2 + H2O là phương trình oxi hóa khử đã được hướng dẫn chi tiết đầy đủ dưới đây giúp các bạn học viết và cân bằng chính xác phản ứng khi cho Zn tác dụng với HNO3 loãng theo phương pháp cân bằng electron.
Mục lục bài viết
1. Phương trình phản ứng Zn tác dụng HNO3 loãng ra N2:
5Zn + 12HNO3 → 5Zn(NO3)2 + N2 + 6H2O
2. Điều kiện phản ứng xảy ra khi cho Zn+ HNO3 loãng:
Nhiệt độ thường
3. Bài tập vận dụng liên quan:
Câu 1. Nhỏ từ từ dung dịch NaOH đến dư vào ống nghiệm chứa Zn(NO3)2. Hiện tượng thu được sau phản ứng là
A. xuất hiện kết tủa trắng.
B. xuất hiện kết tủa màu nâu đỏ.
C. xuất hiện kết tủa trắng, sau đó kết tủa tan.
D. xuất hiện kết tủa trắng xanh, sau đó kết tủa tan.
Hướng dẫn giải
Đáp án C
Phương trình phản ứng xảy ra
2NaOH + Zn(NO3)2 → 2NaNO3+ Zn(OH)2↓
Zn(OH)2: kết tủa trắng, sau đó NaOH dư, kết tủa tan theo phương trình:
2NaOH + Zn(OH)2↓ → K2ZnO2 (dd)+ 2H2O
Câu 2. Hòa tan hoàn toàn 6,5 gam Zn trong dung dịch HNO3 loãng, dư thu được dung dịch X và 0,224 lít khí N2 (đktc). Khối lượng muối trong dung dịch X là
A. 18,90 gam.
B. 17,80 gam.
C. 19,9 gam.
D. 28,35 gam.
Hướng dẫn giải
Đáp án C
nZn= 6,5/65 = 0,1 (mol); nN2= 0,224/22,4 = 0,01 (mol)
Ta thấy:
necho= 2nZn = 0,4 (mol) > ne nhận= 10nN2 = 0,2 (mol) → Sản phẩm khử có chứa NH4NO3
Quá trình cho – nhận e:
0Zn → Zn+2 + 2e +5N + 10e → 20N(N2)
2+5N + 8e→−3N (NH4NO3)
Áp dụng bảo toàn e:
2nZn= 10nN2+ 8nNH4NO3
⇔ 2.0,1 = 10.0,01 + 8nNH4NO3 ⇔ nNH4NO3 = 0,0125 (mol)
Muối trong dung dịch X gồm: 0,1 mol Zn(NO3)2 và 0,025 mol NH4NO3
→ mmuối = 0,1.189 + 0,0125.80 = 19,9 gam
Câu 3. Hòa tan hoàn toàn 13,00 gam Zn trong dung dịch HNO3 loãng, dư thu được dung dịch X và 0,448 lít khí X duy nhất (đktc). Cô cạn dung dịch X thu được 39,8 gam chất rắn. Khí X là:
A. NO2
B. N2
C. N2O
D. NO
Hướng dẫn giải
Đáp án B
Chất rắn khan thu được chứa Zn(NO3)2 và có thể có NH4NO3.
Ta có: nZn(NO3)2 = nZn = 0,2 mol
Giả sử 1 phân tử khí trao đổi n electron.
BT electron: ne cho = ne nhận => 2nZn = 8nNH4NO3 + n.nkhí => 2.0,2 = 8.0,025 + n.0,02
=> n = 10 => X là N2
Câu 4. Có các lọ riêng biệt đựng các dung dịch không màu : Cu(NO3)2, AlCl3, ZnCl2, FeSO4, Fe(NO3)3, NaCl. Chỉ dùng dung dịch nào dưới đây để phân biệt các lọ mất nhãn trên?
A. Na2CO3
B. Ba(OH)2
C. NH3
D. NaOH
Hướng dẫn giải
Đáp án C
Dùng dung dịch NH3
Câu 5. Cho 1,12 lít khí N2 tác dụng với 4,48 lít khí H2 tạo ra V lít khí NH3 (điều kiện tiêu chuẩn). Biết hiệu suất phản ứng là 25%. Tính giá trị của V?
A. 2,24 lít
B. 5,6 lít
C. 0,56 lít
D. 1,12 lít
Hướng dẫn giải
Đáp án C
Phương trình hóa học:
Phản ứng: N2 + 3H2 → 2NH3
Ban đầu: 0,05 0,2 mol
(So sánh thấy: 0,05/1 < 0,2/3 nên hiệu suất tính theo N2 => nN2 pư = 0,05.25% = 0,0125 mol)
N2 + 3H2 → 2NH3
0,0125 → 0,0375 → 0,025
→ V = 0,025.22,4 = 0,56 lít
Câu 6. Điểm giống nhau giữa khí nito và khí cacbonic là:
A. Đều không tan trong nước
B. Đều có tính Oxi hóa và tính khử
C. Đều không duy trì sự cháy và sự sống
D. Tất cả đáp án trên đều đúng
Hướng dẫn giải
Đáp án C
Điểm giống nhau giữa N2 và CO2 là: đều không duy trì sự cháy và sự sống.
A sai vì N2 ít tan trong nước
B sai vì CO2 chỉ có tính oxi hóa, không có tính khử vì C có số oxi hóa +4 là số oxi hóa cao nhất, còn O có số oxi hóa -2 nhưng không có phản ứng nào để O tạo thành O2 nên O không có tính khử.
Câu 7. Cho các câu sau nói về tính chất của nito:
1) Hóa lỏng ở nhiệt độ rất thấp (-1960C)
2) Có khả năng đông nhanh
3) Tan nhiều trong nước
4) Nặng hơn Oxi
5) Kém bền, dễ bị phân hủy thành nitơ nguyên tử
Tìm các tính chất không thuộc về khí nitơ?
A. (1); (3); (4)
B. (1); (2)
C. (3); (4); (5)
D. (2); (3); (5)
Hướng dẫn giải
Đáp án C
3) Tan nhiều trong nước
4) Nặng hơn Oxi
5) Kém bền, dễ bị phân hủy thành nitơ nguyên tử
Câu 8. Cho hổn hợp X gồm 0,05 mol Cu; 0,1 mol Zn; 0,15 mol Al vào 500 ml dung dịch HCl. Phản ứng kết thúc thu được dung dịch Y và hổn hợp rắn Z. Cho Z và dung dịch HNO3 có dư thu được 2,24 lít NO (đktc). Tìm nồng độ dung dịch HCl
A. 1,8M
B. 3M
C. 0,9M
D. 2,5M
Hướng dẫn giải
Đáp án C
Các quá trình trao đổi electron là:
Quá trình cho e
Cu → Cu2+ + 2e
Zn → Zn2+ + 2e
Al → Al3+ + 3e
Quá trình nhận e
2H+ + 2e → H2
N+5 + 3e → N+2
Áp dụng bảo toàn electron ta có
2nCu + 2nZn + 3nAl= nHCl + 3nNO
=> 2.0,05 + 2.0,1 + 3.0,15 = nH+ + 3.0,1 => nH+ = 0,45 mol
⇒ nHCl= 0,45 mol ⇒ CM HCl = 0,9M
Câu 9. Cho dung dịch NH3 đến dư vào dung dịch chứa AlCl3 và ZnCl2thu được kết tủa A. Nung A được chất rắn B. Cho luồng hiđro đi qua B nung nóng sẽ thu được chất rắn nào trong số các chất sau?
A. Zn và Al2O3.
B. Al và Zn.
C. Al2O3.
D. Al và ZnO.
Hướng dẫn giải
Đáp án B
AlCl3 + 3NH3+ 6H2O → Al(OH)3 + 3NH4Cl
ZnCl2 + 2NH3 + 2H2O → Zn(OH)2 + 2NH4Cl
Zn(OH)2 + NH3 dư → [Zn(NH3)6](OH)2
Câu 10. Hoà tan hết hỗn hợp X gồm Zn và ZnO trong dung dịch HNO3 loãng dư thấy không có khí bay ra và trong dung dịch chứa 56,7 gam Zn(NO3)2và 4 gam NH4NO3. Phần trăm khối lượng Zn trong X là
A. 33,33%
B. 66,67%
C. 61,61%
D. 50,00%
Hướng dẫn giải
Đáp án B
nZn(NO3)2 = 0,3 mol;
nNH4NO3 = 0,05 mol
ZnO tác dụng với HNO3 không sinh ra sản phẩm khử vì đã đạt số oxi hóa tối đa
Bảo toàn e: 2.nZn= 8.nNH4NO3 => nZn = 4.0,05 = 0,2 mol
Bảo toàn nguyên tố Zn: nZn(NO3)2= nZn+ nZnO
=> nZnO = 0,3 – 0,2 = 0,1 mol
%mZn = 0,2.65/(0,2.65 + 0,1.81).100% = 61,61%
Câu 11. Cho m (g) hỗn hợp Mg, Al, Zn tác dụng với 0,112 lit Cl2 ở đktc, phản ứng xảy ra hoàn toàn thu được chất rắn X. Cho X tác dụng với dung dịch axit HCl dư thu được dung dịch Y và 0,168 lit H2 đktc. Làm khô dung dịch Y thu được 1,245 gam chất rắn khan. m có giá trị là:
A. 0,3575
B. 1,4300
C. 2,1400
D. 0,7150
Hướng dẫn giải
Đáp án A
nCl2 = 0,005 mol
nH2 = 0,0075 mol
nCl- = 2nCl2 + 2nH2= 0,025 mol
Bảo toàn khối lượng: mmuối = mKL + mCl-
=> 1,245 = mKL+ mCl- = m + 0,025.35,5
=> m= 0,3575 g
Câu 12. Dãy kim loại nào trong các dãy sau đây gồm các kim loại đều không tác dụng với dung dịch H2SO4loãng?
A. Al, Mg, Cu
B. Fe, Mg, Ag
C. Al, Fe, Mg
D. Al, Fe, Cu
Hướng dẫn giải
Đáp án C
Câu 13. Cho hỗn hợp gồm 1 mol chất A và 1 mol chất B tác dụng hết với dung dịch H2SO4 đăc, nóng (dư) tạo ra 1 mol khí SO2 (sản phẩm khử duy nhất). Hai chất A, B là
A. Fe, Fe2O3
B. Fe, FeO
C. Fe3O4, Fe2O3
D. FeO, Fe3O4
Hướng dẫn giải
Đáp án D
Xét quá trình cho – nhận e:
Cho e:
Fe: Fe0→Fe+3 + 3e
FeO: +2Fe →+3Fe + 1e
Fe3O4: +8/3Fe3→3+3Fe + 1e
Nhận e: S+6→S+4 + 2e
A. FeO, Fe3O4 : nSO2= (1+1)/2 = 1 mol
B. Fe3O4, Fe2O3: nSO2 = 1/2 = 0,5 mol
C. Fe, Fe2O3: nSO2= 3/2= 1,5mol
D. Fe, FeO: nSO2= (3 + 1)/2 = 2 mol
Câu 14. Để bảo vệ vỏ tàu biển làm bằng thép người ta thường gắn vào phần vỏ tàu (Phần ngâm dưới nước) những tấm kim loại
A. Sn
B. Zn
C. Cu
D. Pb
Hướng dẫn giải
Đáp án B
Để bảo vệ vỏ tàu biển làm bằng thép người ta thường gắn vào phần vỏ tàu (Phần ngâm dưới nước) những tấm kim loại bằng Zn, vì Zn có tính khử mạnh hơn Fe, Zn sẽ bị ăn mòn thay cho Fe (phương pháp điện hóa).
Câu 15. Để tách nhanh Al ra khỏi hỗn hợp Mg, Al, Zn có thể dùng hóa chất nào sau đây ?
A. H2SO4 loãng dư
B. H2SO4 đặc nguội dư
C. Dung dịch nước vôi trong, khí CO2
D. Dung dịch NH3 dư
Hướng dẫn giải
Đáp án B
Để tách nhanh Al ra khỏi hỗn hợp Mg, Al, Zn ta có thể dùng hóa chất: H2SO4 đặc nguội dư
vì Al không phản ứng với H2SO4 đặc nguội
Câu 16. Hệ số của HNO3 trong phản ứng:
Zn + HNO3 → Zn(NO3)2 + N2O + N2 + H2O (biết tỉ lệ mol của N2O : N2 = 2 : 3) là
A. 55.
B. 56.
C. 70.
D. 50.
Hướng dẫn giải
Đáp án B
Vì tỉ lệ mol của N2O : N2 là 2 : 3 => đặt 2 trước N2O và đặt 3 trước N2sau đó tính tổng eletron nhận = 10.5 – 2.2.1 – 0 = 46
Chọn hệ số sao cho tổng electron cho = tổng elron nhận => nhân 23 ở quá trình cho eletron và nhân 1 ở quá trình nhận eletron
23Zn + 56HNO3 → 23Zn(NO3)2+ 2N2O + 3N2 + 28H2O