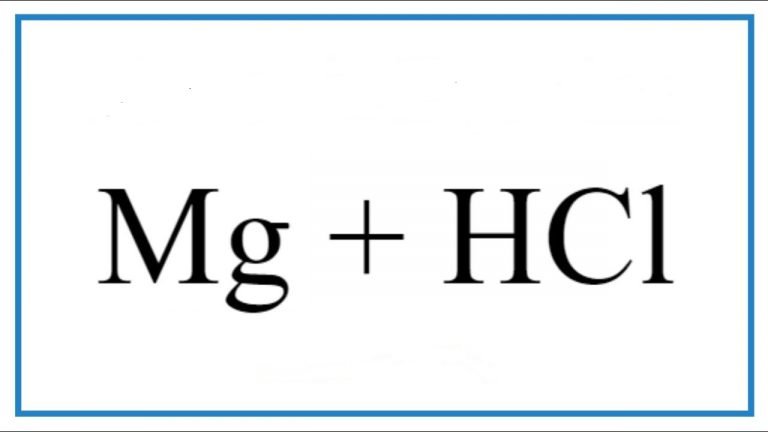Cân bằng: Mg + HNO3 → Mg(NO3)2 + NH4NO3 + H2O được chúng mình biên soạn hướng dẫn bạn đọc viết và cân bằng phương trình phản ứng oxi hóa khử Mg tác dụng HNO3 sản phẩm khử sinh ra là muối NH4NO3. Mời các bạn tham khảo.
Mục lục bài viết
1. Cân bằng phương trình Mg + HNO3 -> Mg(NO3)2 + NH4NO3 + H2O:
Để cân bằng phương pháp hóa học này, bạn cần điều chỉnh hệ số trước các chất trong phản ứng sao cho số hiệu nguyên tử của các nguyên tố ở hai vế của phương pháp là như nhau. Phương trình ban đầu là:
Mg + HNO3 -> Mg(NO3)2 + NH4NO3 + H2O
Bước 1: Cân bằng các nguyên tố phi nguyên tử trong phản ứng.
H: 1 nguyên tử ở bên trái và 6 nguyên tử ở bên phải (trong NH4NO3 và H2O).
N: 1 nguyên tử ở bên trái và 4 nguyên tử ở bên phải (tính bằng Mg(NO3)2 và NH4NO3).
Mg: 1 nguyên tử ở bên trái và 1 nguyên tử ở bên phải (tính bằng Mg(NO3)2).
O: 3 atom bên trái và 10 nguyên tử bên phải (trong Mg(NO3)2, NH4NO3 và H2O).
Bước 2: Bắt đầu điều chỉnh hệ số. Chúng ta có thể bắt đầu bằng cách cân bằng số nguyên tử của nguyên tử H và N. Đặt hệ số 3 vào trước H2O và 10 vào trước HNO3 để cân bằng số nguyên tử của H và N: Mg + 10HNO3 -> Mg(NO3) 2 + NH4NO3 + 3H2O
Bước 3: Cân bằng số nguyên tử của N: 10 nguyên tử ở bên trái và 4 nguyên tử ở bên phải. Để cân bằng số nguyên tử của nitơ (N), ta có thể đặt hệ số 4 trước Mg(NO3)2: Mg + 10HNO3 -> 4Mg(NO3)2 + NH4NO3 + 3H2O. Vì vậy, hệ số 4 phải được thêm vào trước Mg để cân bằng số lượng nguyên tử Mg.
Bước 4: Kiểm tra lại tất cả các nguyên tử ở cả hai bên. Mg: 4 nguyên tử ở bên trái và 4 nguyên tử ở bên phải (cân bằng). N: 10 nguyên tử ở bên trái và 10 nguyên tử ở bên phải (cân bằng). H: 10 nguyên tử ở bên trái và 10 nguyên tử ở bên phải (cân bằng). O: 30 nguyên tử ở bên trái và 30 nguyên tử ở bên phải (cân bằng).
Phản ứng sau khi cân bằng là: 4Mg + 10HNO3 -> 4Mg(NO3)2 + NH4NO3 + 3H2O Phản ứng này đã cân bằng về mặt nguyên tử.
2. Đặc điểm, tính chất của Mg, HNO3:
*Mg
Tính chất vật lý của magiê:
+ Màu sắc và trạng thái: Magiê có màu trắng và tồn tại dưới dạng kim loại rắn ở nhiệt độ phòng.
+ Trọng lượng riêng: Magiê có trọng lượng riêng thấp, làm cho nó trở nên dễ cắt, dẻo và dễ uốn cong.
+ Nhiệt độ nóng chảy: Nhiệt độ nóng chảy của magiê là khoảng 650 độ C (1,202 độ F).
+ Dẫn điện và dẫn nhiệt: Magiê là chất dẫn điện và nhiệt tốt. Điều này làm cho nó được sử dụng trong nhiều ứng dụng công nghiệp và trong các sản phẩm hợp kim lớn.
Tính chất hóa học của magiê:
+ Phản ứng với nước: Magiê phản ứng với nước tạo thanh hidroxit magiê (Mg(OH)2) và khí hiđro (H2).
Mg + 2H2O -> Mg(OH)2 + H2
+ Phản ứng với axit: Magiê có thể phản ứng với axit tạo ra muối và khí hydro.
Ví dụ: Mg + 2HCl -> MgCl2 + H2
*Acid nitric (HNO3):
Tính chất vật lý của acid nitric:
+ Dạng: Axit nitric thường tồn tại dưới dạng dung dịch trong nước và là chất tồn dư trong điều kiện thường.
+ Màu sắc: Có màu vàng hoặc vàng đậm tùy theo nồng độ.
Tính chất hóa học của acid nitric:
+ Axit mạnh: Axit nitric là axit mạnh, có khả năng sinh proton mạnh (H+) nên có tính ăn mòn, oxy hóa cao.
+ Oxy hóa: Axit nitric là chất oxy hóa mạnh và có thể oxy hóa nhiều chất khác, thậm chí cả kim loại để tạo ra nitrat tương ứng.
+ Phản ứng với kim loại: Axit nitric phản ứng với kim loại như sắt tạo ra muối nitrat và khí hydro.
Mg + 2HNO3 -> Mg(NO3)2 + H2O + NO2
+ Phản ứng với các chất hữu cơ: Axit nitric có khả năng oxy hóa và nitrat hóa các chất hữu cơ, gây ra phản ứng nổ mạnh khi kết hợp với các chất chứa nhiên liệu.
3. Một số bài tập vận dụng liên quan:
Bài 1. Cho phương trình: Mg + HNO3 → Mg(NO3)2+ NH4NO3 + H2O. Tổng hệ số cân bằng tối giản của phản ứng trên là bao nhiêu?
A. 23
B. 24
C. 18
D. 22
Đáp án đung là đáp án D
Phương trình phản ứng hóa học 4Mg + 10HNO3 → 4Mg(NO3)2 + NH4NO3 + 3H2O
Tổng hệ số cân bằng của phản ứng trên là 4 + 10 + 4 + 1 + 3 = 22
Bài 2. Cho dãy các chất sau: Al, NaHCO3, (NH4)2CO3 , NH4Cl, Al2O3 , Zn, K2CO3 , K2SO4. Hãy cho biết, có bao nhiêu chất trong dãy vừa tác dụng được với dung dịch HCl, vừa tác dụng được với dung dịch NaOH?
A. 2
B. 3
C. 4
D. 5
Đáp án đung là đáp án D
Các chất phản ứng được với cả axit và bazơ gồm: các kim loại Al, Zn, Sn, Be, Pb,… và các chất lưỡng tính, muối có khả năng tạo liên kết kết tủa… Các chất lưỡng tính:
+ Là oxy và hydroxit của kim loại Al, Zn, Sn, Pb; Cr(OH)3 và Cr2O3.
+ Là những chất âm còn chứa H, có khả năng phân ly thành ion H+ của các chất điện ly trung bình và yếu (HCO3-, HPO42-, HS-…) (lưu ý: HSO4- có tính axit vì là chất điện ly mạnh)
+ Là nơi lưu giữ các ion lưỡng tính; được tạo ra bởi hai ion, một axit và một bazơ ((NH4)2CO3…) Vậy chúng ta có 5 chất thỏa mãn là : Al, NaHCO3, (NH4)2CO3 , Al2O3, Zn.
Bài 3. Cho sắt tác dụng axit HNO3 loãng dư thu được chất khí X là sản phẩm khử duy nhất có tỷ khối so với oxi là 1,4375. Sản phẩm khử của HNO3 là:
A.NH4NO3
B. NO
C. N2O
D. NO2
Đáp án đung là đáp án D
MX= 1,4375.32 = 46 ⇒ X là NO2
Bài 4. Cho 3,6 g Mg tác dụng với dụng axit HNO3 loãng thu được dung dịch muối không màu và không thấy có khí thoát ra. Hãy cho biết, khối lượng muối thu được là
A. 4,84 g
B. 2,22 g
C. 5,22 g
D. 3,02 g
Đáp án đung là đáp án C
nMg = 0,15 mol ⇒ nMg(NO3)2 = 0,15 mol; nNH4NO3 = 0,15/4 = 0,0375 mol
m muối = mMg(NO3)2 + mNH4NO3 = 0,015.148 + 0,0375.80 = 5,44 g
Bài 5. Cho các nhận xét dưới đây (a) Tính chất hoá học đặc trưng của kim loại là tính khử. (b) Đồng (Cu) không khử được muối sắt(III) (Fe3+). (c) Ăn mòn kim loại là một quá trình hoá học trong đó kim loại bị ăn mòn bởi các axit trong môi trường không khí. (d) Để bảo vệ vỏ tàu biển làm bằng thép, người ta gắn vào mặt ngoài vỏ tàu (phần chìm trong nước biển) những khối kẽm. Số nhận định đúng là
A. 2.
B. 3.
C. 4.
D. 1.
Đáp án đung là đáp án A
a) Tính chất hóa học điển hình của kim loại là tính khử.
d) Để bảo vệ thân tàu bằng thép, người ta gắn các khối kẽm vào bên ngoài thân tàu (phần chìm trong nước biển).
Bài 6. Hòa tan hỗn hợp gồm 2,7 gam Al và 13 gam Zn bằng 500 ml dung dịch HNO3 vừa đủ, thu được dung dịch X và không thấy khí thoát ra. Cô cạn dung dịch X thu a gam muối. Giá trị của a:
A. 66,1 gam
B. 68,2 gam
C. 43,4 gam
D. 33,1 gam
Đáp án đung là đáp án A
nAl = 2,7/27 = 0,1 mol
nZn = 13/65 = 0,2 mol
Không thoát khí => Sản phẩm khử trùng là NH4NO3 ⇒ nNH4NO3 = (0.1.3 + 0.2.2)/8 = 0.7/8 mol
Dung dịch muối X gồm: Al(NO3)3 (0,1 mol); Zn(NO3)2 (0,2 mol), NH4NO3 (0,7/8 mol)
m = mAl(NO3)3 + mZn(NO3)2 + mNH4NO3 = 0,1.213 + 0,2.189 + (0,7/8). 80 = 66,1 gam
Bài 7. Cho 1,35 gam hỗn hợp gồm Cu, Mg, Al tác dụng hết với dung dịch HNO3 thu được hỗn hợp khí gồm 0,224 lít NO và 0,896 lít NO2 (không còn sản phẩm khử nào khác của N+5). Khối lượng muối trong dung dịch là. (Thể tích khí ở điều kiện tiêu chuẩn)
A. 10,08 gam.
B. 6,59 gam.
C. 5,69 gam.
D. 5,96 gam.
Đáp án đung là đáp án: C
Bảo toàn e: ne cho = ne nhận = 3.nNO + nNO2 = 3.0,01 + 0,04 = 0,07 mol
=> nNO3- (trong muối) = ne cho= 0,07 mol
=> mmuối = mkim loại + mNO3-= 1,35 + 0,07.62 = 5,69