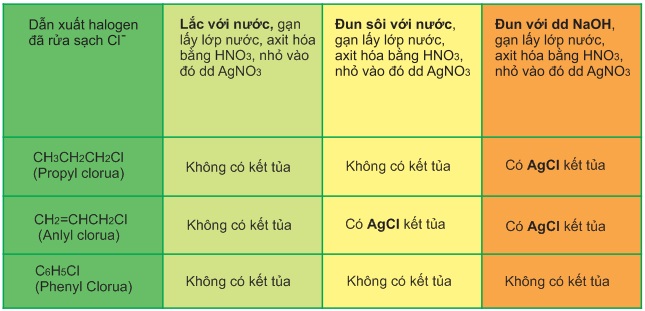
Cách nhận biết các chất hóa học lớp 8 và 9 nằm trong chuyên đề hóa 8 phần nhận biết các chất, giúp các bạn học sinh được nâng cao vận dụng khả năng phân tích, từ các tính chất cơ bản của các chất. Mời các bạn cùng tham khảo.
Mục lục bài viết
1. Cách nhận biết đối với chất khí:
Có nhiều phương pháp để nhận biết các chất khí khác nhau, nhưng phổ biến nhất là dùng các thuốc thử hóa học có phản ứng đặc trưng với chất khí cần nhận biết. Một số ví dụ về thuốc thử và hiện tượng nhận biết các chất khí như sau:
– Khí CO: Dùng dung dịch PdCl2, nếu có khí CO thì dung dịch bị sẫm màu và có khí thoát ra.
– Khí CO2: Dùng dung dịch nước vôi trong, nếu có khí CO2 thì dung dịch bị đục, sau đó trong suốt khi thêm Ca(OH)2 dư hoặc Ba(OH)2 dư.
– Khí SO2: Dùng dung dịch brom hoặc thuốc tím, nếu có khí SO2 thì làm mất màu dung dịch.
– Khí SO3: Dùng dung dịch BaCl2, nếu có khí SO3 thì tạo kết tủa trắng BaSO4.
– Khí NH3: Dùng giấy quỳ ẩm hoặc dung dịch phenolphtalein, nếu có khí NH3 thì giấy quỳ chuyển sang màu xanh hoặc dung dịch chuyển sang màu hồng.
– Khí clo: Dùng giấy lọc nhúng trong dung dịch KI, nếu có khí clo thì giấy lọc chuyển sang màu nâu đỏ.
– Khí H2S: Dùng giấy lọc nhúng trong dung dịch Pb(CH3COO)2, nếu có khí H2S thì giấy lọc chuyển sang màu đen.
– Khí HCl: Dùng giấy quỳ ẩm hoặc dung dịch phenolphtalein, nếu có khí HCl thì giấy quỳ chuyển sang màu đỏ hoặc dung dịch mất màu.
– Khí NO: Dùng dung dịch FeSO4 và H2SO4 loãng, nếu có khí NO thì tạo kết tủa nâu đỏ Fe(OH)3.
– Khí NO2: Dùng dung dịch KI và tinh bột, nếu có khí NO2 thì dung dịch chuyển sang màu xanh lam.
– Khí O3: Dùng giấy lọc nhúng trong dung dịch KI và tinh bột, nếu có khí O3 thì giấy lọc chuyển sang màu xanh lam.
– Khí O2: Dùng que diêm đã cháy rụi, nếu có khí O2 thì que diêm lại bùng cháy.
– Khí N2: Không có phương pháp hóa học để nhận biết khí N2 riêng biệt, chỉ có thể phân biệt với các chất khí khác bằng cách loại trừ.
2. Cách nhận biết dung dịch bazo (kiềm):
Để nhận biết dung dịch bazo (kiềm), ta sử dụng các phương pháp sau:
– Quan sát màu sắc: Khi thêm một vài giọt dung dịch bazo vào giấy quỳ tím, màu của giấy quỳ tím sẽ chuyển từ màu đỏ sang màu xanh. Đây là một phản ứng phổ biến để nhận biết dung dịch bazo.
– Kiểm tra pH: Dung dịch bazo có tính kiềm, do đó, nếu sử dụng bộ chỉ thị pH, như quỳ tím hoặc phenolphtalein, dung dịch bazo sẽ thay đổi màu để chỉ ra tính kiềm. Ví dụ, quỳ tím sẽ chuyển sang màu xanh trong dung dịch bazo.
– Phản ứng với axit: Dung dịch bazo có khả năng tương tác với axit. Khi dung dịch bazo được trộn với một dung dịch axit, sẽ xảy ra phản ứng trung hòa và tạo ra muối và nước. Điều này có thể được nhận biết thông qua sự thay đổi màu sắc hoặc hiện tượng khí thoát ra.
– Phản ứng với kim loại: Một số dung dịch bazo có khả năng tác dụng với kim loại, tạo ra muối và khí hiđro. Ví dụ, dung dịch NaOH (hidroxit natri) có thể tác dụng với nhôm để tạo ra muối nhôm và khí hiđro.
Lưu ý rằng việc nhận biết dung dịch bazo cần được thực hiện cẩn thận và theo hướng dẫn an toàn.
3. Cách nhận biết dung dịch axit:
Có một số cách để nhận biết axit, chẳng hạn như:
– Dùng chỉ thị hoá học: Chỉ thị hoá học là những chất có màu sắc khác nhau khi phản ứng với axit và bazơ. Ví dụ, phenolphtalein có màu hồng khi gặp bazơ và không màu khi gặp axit, quỳ tím có màu đỏ khi gặp axit và xanh khi gặp bazơ.
– Dùng giấy quỳ: Giấy quỳ là một loại giấy được thấm các chỉ thị hoá học. Giấy quỳ có hai loại: giấy quỳ đỏ và giấy quỳ xanh. Giấy quỳ đỏ chuyển sang xanh khi gặp bazơ và không đổi màu khi gặp axit, giấy quỳ xanh chuyển sang đỏ khi gặp axit và không đổi màu khi gặp bazơ.
– Dùng độ pH: Độ pH là chỉ số đo lường nồng độ ion H+ trong dung dịch. Độ pH có thể được xác định bằng các thiết bị như máy đo pH hoặc giấy pH. Axit là những chất có độ pH nhỏ hơn 7, càng nhỏ thì càng mạnh.
– Dùng phản ứng hoá học: Axit có thể phản ứng với một số kim loại, giải phóng khí hiđro và tạo muối. Ví dụ, HCl + Zn -> ZnCl2 + H2. Axit cũng có thể phản ứng với bazơ, tạo muối và nước. Ví dụ, HCl + NaOH -> NaCl + H2O.
4. Cách nhận biết dung dịch muối:
Dưới đây là một số cách nhận biết dung dịch muối:
– Quan sát hiện tượng: Các dung dịch muối thường có những hiện tượng đặc trưng khi tiếp xúc với các chất khác. Ví dụ, dung dịch muối clorua (như NaCl) khi tiếp xúc với dung dịch bạc nitrat (AgNO3) sẽ tạo ra kết tủa trắng bạc clorua (AgCl). Điều này là một dấu hiệu để nhận biết dung dịch muối clorua.
– Quan sát màu sắc: Một số dung dịch muối có màu sắc đặc trưng. Ví dụ, dung dịch muối đồng (CuSO4) có màu xanh, dung dịch muối sắt (FeCl3) có màu vàng nâu. Quan sát màu sắc của dung dịch có thể giúp nhận biết loại muối.
– Kiểm tra pH: Một số dung dịch muối có tính axit hoặc kiềm. Bạn có thể sử dụng bộ chỉ thị pH để kiểm tra tính axit hoặc kiềm của dung dịch muối. Ví dụ, dung dịch muối natri cacbonat (Na2CO3) có tính kiềm, trong khi dung dịch muối axit clohidric (HCl) có tính axit.
– Phản ứng hóa học: Một số dung dịch muối có khả năng tạo ra phản ứng hóa học đặc trưng. Ví dụ, dung dịch muối natri hidroxit (NaOH) có khả năng tác dụng với dung dịch axit clohidric (HCl) để tạo ra muối natri clorua (NaCl) và nước.
Ví dụ:
– Muối clorua: Dùng dung dịch AgNO3, nếu xuất hiện kết tủa trắng là AgCl thì dung dịch chứa muối clorua.
– Muối sunfat: Dùng dung dịch BaCl2 hoặc Ba(OH)2, nếu xuất hiện kết tủa trắng là BaSO4 thì dung dịch chứa muối sunfat.
– Muối cacbonat: Dùng dung dịch HCl hoặc H2SO4, nếu có hiện tượng sủi bọt khí CO2 thì dung dịch chứa muối cacbonat.
– Muối sunfua: Dùng dung dịch Pb(NO3)2, nếu xuất hiện kết tủa đen là PbS thì dung dịch chứa muối sunfua.
– Muối phôtphat: Dùng dung dịch AgNO3 hoặc dùng dung dịch CaCl2, Ca(OH)2, nếu xuất hiện kết tủa trắng là Ca3(PO4)2 thì dung dịch chứa muối phôtphat.
5. Các cách nhận biết các oxit của kim loại:
Các cách nhận biết các oxit của kim loại có thể dựa vào các đặc điểm sau:
– Màu sắc: Một số oxit của kim loại có màu sắc đặc trưng, ví dụ: FeO (sắt (II) oxit) có màu đen, Fe2O3 (sắt (III) oxit) có màu nâu đỏ, CuO (đồng (II) oxit) có màu đen, Cu2O (đồng (I) oxit) có màu đỏ gạch.
– Tính tan: Các oxit của kim loại thường không tan trong nước, nhưng có thể tan trong các dung dịch axit hoặc kiềm. Ví dụ: BaO (bari oxit) không tan trong nước nhưng tan trong HCl và NaOH, tạo ra muối và nước.
– Phản ứng với nước: Một số oxit của kim loại kiềm và kiềm thổ có khả năng phản ứng với nước, tạo ra dung dịch kiềm. Ví dụ: Na2O (natri oxit) phản ứng với nước tạo ra NaOH (natri hidroxit).
– Phản ứng với axit: Các oxit của kim loại thường phản ứng với axit, tạo ra muối và nước. Ví dụ: CaO (canxi oxit) phản ứng với H2SO4 (axit sunfuric) tạo ra CaSO4 (canxi sunfat) và H2O.
– Phản ứng với oxit axit: Các oxit của kim loại cũng có thể phản ứng với các oxit axit, tạo ra muối. Ví dụ: MgO (magie oxit) phản ứng với CO2 (cacbon điôxít) tạo ra MgCO3 (magie cacbonat).
6. Các bài tập nhận biết chất hóa học và lời giải:
Bài 1: Cho biết các chất hóa học sau có phải là axit hay không? Nếu là axit, cho biết công thức phân tử và tên gọi của nó.
– Nước cốt chanh
– Nước súc miệng
– Nước mắm
– Nước ngọt
Lời giải:
– Nước cốt chanh có chứa axit citric (C6H8O7), là một axit yếu có mùi thơm đặc trưng của chanh.
– Nước súc miệng có chứa axit acetic (CH3COOH), là một axit yếu có mùi hăng của dấm.
– Nước mắm có chứa axit glutamic (C5H9NO4), là một axit amin có vị ngọt đặc trưng của nước mắm.
– Nước ngọt có chứa axit carbonic (H2CO3), là một axit yếu có khả năng tạo bọt khí carbon dioxide (CO2) khi phản ứng với nước.
Bài 2: Cho biết các chất hóa học sau có phải là bazơ hay không? Nếu là bazơ, cho biết công thức phân tử và tên gọi của nó.
– Xà phòng
– Sữa
– Nước rửa bát
– Nước cơm
Lời giải:
– Xà phòng có chứa bazơ natri hiđroxit (NaOH), là một bazơ mạnh có khả năng tẩy rửa và khử trùng.
– Sữa có chứa bazơ canxi hiđroxit (Ca(OH)2), là một bazơ yếu có vị ngọt và đặc tính dinh dưỡng cao.
– Nước rửa bát có chứa bazơ amoni hiđroxit (NH4OH), là một bazơ yếu có khả năng tẩy rửa và khử mùi hôi.
– Nước cơm có chứa bazơ kali hiđroxit (KOH), là một bazơ mạnh có vị đắng và đặc tính khử trùng.
Bài 3: Bằng phương pháp hoá học hãy nhận biết các chất rắn riêng biệt sau:
a) BaO, MgO, CuO
b) CuO, Al, MgO, Ag
Lời giải:
a) BaO, MgO, CuO:
– Ta có thể dùng dung dịch HCl để nhận biết các chất này. BaO tan trong HCl tạo ra muối BaCl2 và khí H2O. MgO tan ít trong HCl tạo ra muối MgCl2 và khí H2O. CuO không tan trong HCl. Vì vậy, ta có thể lọc dung dịch sau khi cho HCl vào hỗn hợp để thu được kết tủa CuO. Sau đó, cô cạn dung dịch lọc để thu được muối BaCl2 và MgCl2.
– Ta có thể nhận biết hai muối này bằng cách cho dung dịch Na2SO4 vào. Muối BaCl2 sẽ tạo ra kết tủa trắng BaSO4, còn muối MgCl2 không tạo kết tủa.
b) CuO, Al, MgO, Ag:
Có thể dùng nước để nhận biết các chất này. Al tan trong nước tạo ra muối Al(OH)3 và khí H2. MgO tan ít trong nước tạo ra dung dịch kiềm Mg(OH)2. CuO và Ag không tan trong nước. Vì vậy, ta lọc dung dịch sau khi cho nước vào hỗn hợp để thu được kết tủa CuO và Ag. Sau đó, nhận biết hai chất này bằng cách cho dung dịch HNO3 vào. CuO sẽ tan trong HNO3 tạo ra muối Cu(NO3)2 và khí NO. Ag sẽ không tan trong HNO3.