Xin giới thiệu phương trình C6H5OH + HNO3 → C6H2(NO2)3OH + H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học.
Mục lục bài viết
1. Phương trình phản ứng C6H5OH ra C6H2(NO2)3OH:
C6H5OH + 3HNO3 → C6H2(NO2)3OH + 3H2O
2. Phân tích phản ứng hóa học C6H5OH ra C6H2(NO2)3OH:
2.1. Hiện tượng nhận biết phản ứng:
Phenol tác dụng với axit nitric đặc có xúc tác là axit sulfuric đặc, nóng tạo 2,4,6 – trinitrophenol (axit picric).
Không chỉ Phenol mà tất cả các chất thuộc loại Phenol có nguyên tử H ở vị trí o, p so với nhóm OH đều có thể tham gia vào phản ứng thế Brom và thế nitơ như trên.
2.2. Điều kiện để phản ứng xảy ra Phenol HNO3:
Điều kiện để phản ứng: Không có
2.3. Bản chất của các chất tham gia phản ứng:
Bản chất của C6H5OH (Phenol)
Phenol mang tính chất của vòng benzen tham gia được phản ứng thế nguyên tử H ở vòng benzen. Khi cho dung dịch HNO3 đặc tác dụng với phenol có xúc tác H2SO4 đặc xuất hiện kết tủa vàng axit picric.
Bản chất của HNO3 (Axit nitric)
HNO3 là một axit mạnh tác dụng được với phenol.
2.4. Cách thực hiện phản ứng:
Cho C6H5OH (Phenol) tác dụng HNO3 (axit nitric) và tạo ra chất H2O (nước), C6H2OH(NO2)3 (Axit picric).
2.5. Tính chất hóa học:
Tính chất hóa học của C6H5OH
Nhân hút e, –OH đẩy e.
a. Phản ứng thế nguyên tử hidro của nhóm OH:
‐ Tác dụng với kim loại kiềm
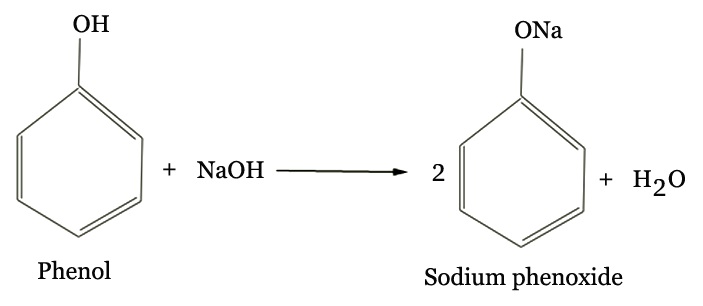
C6H5OH + Na → C6H5ONa (Natri phenolat) + 1/2 H2↑
‐ Tác dụng với Bazo:
C6H5OH (rắn, không tan) + NaOH → C6H5ONa (tan, trong suốt) + H2O
Phenol có tính axit, tính axit của phenol rất yếu, dung dịch phenol không làm đổi màu quỳ tím.
Chú ý: tính axit yếu, không làm đổi màu quỳ tím, thứ tự: nấc II của H2CO3 < phenol < nấc I của H2CO3.
⇒ Có phản ứng:
C6H5ONa (dd trong suốt) + H2O + CO2 → C6H5OH (vẩn đục) + NaHCO3
C6H5OH + Na2CO3 → C6H5ONa + NaHCO3
b. Tính chất của nhân thơm (Phản ứng thế vào vòng benzen):
Thay thế brom: Khi phenol phản ứng với dung dịch brom tạo thành 2,4,6-tribromophenol dưới dạng kết tủa trắng.
Thay thế nitro: cho phenol và HNO3 đặc phản ứng với H2SO4 đặc nóng làm chất xúc tác để tạo ra 2,4,6-trinitrophenol (axit picric):
C6H5OH + 3HNO3 → C6H2(NO2)3OH + 3H2O
c. Phản ứng tạo nhựa phenolfomandehit:
Cho phenol tác dụng với dung dịch HCHO trong môi trường axit tạo ra sản phẩm là nhựa phenolfomandehit
nC6H5OH + nHCHO → nH2O + (HOC6H2CH2)n
Tính chất hóa học của HNO3:
a. Axit nitric là một trong những axit mạnh nhất:
Axit nitric là một trong những axit mạnh nhất. Nó là một axit khan – một axit đơn chức mạnh có khả năng nitrat hóa nhiều hợp chất vô cơ với hằng số cân bằng axit (pKa) = -2.
Axit nitric phân li hoàn toàn thành ion H và NO3 trong dung dịch loãng. Dung dịch HNO3 làm quỳ tím chuyển sang màu đỏ.
HNO3 phản ứng với oxit bazơ, bazơ và muối của axit yếu hơn tạo thành muối nitrat.
Ví dụ:
CuO + 2HNO3 → Cu(NO3)2 + H2O
CaCO3 + 2HNO3 → Ca(NO3)2 + H2O + CO2
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
Axit nitric tác dụng với oxit bazơ, bazơ, muối mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
Ví dụ:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
b. Axit nitric có tính oxi hóa:
Axit nitric cũng là một trong những axit có tính oxi hóa mạnh nhất. Nó có thể bị khử thành các sản phẩm nitơ khác nhau tùy thuộc vào tính axit mạnh hay yếu của chất khử. Cùng nghiên cứu quá trình oxy hóa axit nitric thông qua ba phản ứng:
Một là tác dụng với kim loại
Thứ hai, tác dụng với phi kim
Thứ ba, tác dụng của hợp chất
‐ Tác dụng với kim loại
Axit nitric có thể oxi hóa hầu hết các kim loại tạo muối nitrat, kể cả các kim loại có tính khử yếu (Cu, Ag)… trừ Pt và Au. Lúc này kim loại bị oxi hóa ở mức cao nhất. Sản phẩm của phản ứng này là NO2(4) đối với HNO3 đặc và NO(2) đối với HNO3 loãng. Nhôm, sắt và crom được thụ động hóa để làm mát bằng axit nitric đậm đặc dưới dạng màng oxit bền để bảo vệ chúng khỏi quá trình oxy hóa. Đây cũng là lý do người ta dùng bình nhôm hoặc bình sắt để đựng HNO3 đặc.
Phương trình phản ứng:
Kim loại + HNO3 đặc → muối nitrat + NO + H2O (nhiệt độ)
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
Ví dụ:
Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2(↑) + 2H2O
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO (↑) + 4H2O
‐ Tác dụng với phi kim:
HNO3 đặc có thể oxi hóa được các phi kim như S, C, P… (các nguyên tố kim loại trừ halogen và silic) khi đun nóng. Các sản phẩm được hình thành là nitơ đioxit (nếu là axit nitric đậm đặc) và oxit nitơ (với axit loãng và nước).
Ví dụ:
S + 6HNO3 đặc → H2SO4 + 6NO2(↑) + 2H2O (nhiệt độ)
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
P + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
‐ Tác dụng với hợp chất:
Là một trong những axit cực mạnh, Axit nitric đặc (HNO3) là một trong những axit có tính oxi hóa mạnh – phá hủy nhiều loại hợp chất vô cơ và hữu cơ khác nhau. Vải, giấy, mùn cưa,…đều bị phá hủy hoặc bốc cháy khi tiếp xúc với HNO3 đặc. Đây là lý do tại sao rất nguy hiểm khi để axit nitric (HNO3) tiếp xúc với cơ thể con người.
3. Bài tập vận dụng liên quan:
Câu 1: Nhận xét nào sau đây về phenol (C6H5OH) là không đúng?
A. Không bị oxi hóa khi để lâu trong không khí.
B. Phản ứng với nước Br2 tạo kết tủa
C. Dung dịch không làm đổi màu quỳ tím.
D. Tan được vào dung dịch KOH.
Câu 2: Một chất tác dụng được với dung dịch natri phenolat tạo thành phenol. Chất đó là
A. Na2CO3.
B. C2H5OH.
C. NaCl.
D. CO2.
Câu 3: Phenol có khả năng dễ tham gia phản ứng thế với dung dịch Br2 vì
A. Trong phân tử có chứa nhóm OH hút điện tử.
B. Có vòng benzen hút điện tử.
C. Có nguyên tử H linh động trong nhóm OH.
D. Có nhóm OH đẩy điện tử vào vòng benzen làm H trong vòng dễ bị thế.
Câu 4: Phản ứng giữa CO2 với dung dịch C6H5ONa xảy ra theo phương trình hóa học sau:
CO2 + H2O + C6H5ONa → C6H5OH + NaHCO3.
Phản ứng xảy ra được là do phenol có:
A. Tính oxi hóa mạnh hơn axit cacbonic.
B. Tính oxi hóa yếu hơn axit cacbonic.
C. Tính axit mạnh hơn axit cacbonic.
D. Tính axit yếu hơn axit cacbonic.
4. Hướng dẫn lời giải:
Câu 1:
Đáp án: A. Không bị oxi hóa khi để lâu trong không khí.
Phenol là hợp chất thơm tồn tại ở trạng thái tinh thể, ít tan trong nước nhưng để lâu trong không khí ẩm lại bị chảy rữa do hút nước, ngoài ra, nó còn dễ bị oxi hóa bởi oxi trong không khí chuyển thành màu hồng.
(Hoặc dùng phương pháp loại trừ B,C,D hiển nhiên đúng).
Câu 2:
Đáp án: D. CO2
Tính axit của C6H5OH < H2CO3 nên muối C6H5ONa bị axit cacbonic đẩy ra khỏi muối.
CO2+ H2O + C6H5ONa → C6H5OH + NaHCO3
Câu 3: D. Có nhóm OH đẩy điện tử vào vòng benzen làm H trong vòng dễ bị thế.
Phenol có khả năng dễ tham gia phản ứng thế với Br2 vì có nhóm OH đẩy điện tử vào vòng benzen làm H trong vòng dễ bị thế.
C6H5OH + 3Br2 → C6H2Br3OH + 3HBr
Câu 4:
Đáp án: D. Tính axit yếu hơn axit cacbonic
Dựa vào tính chất: axit mạnh hơn đẩy axit yếu hơn ra khỏi muối tạo thành muối mới và axit mới yếu hơn axit ban đầu.
Do đó axit cacbonic có tính axit mạnh hơn phenol.
5. Tìm hiểu thêm về phenol:
5.1. Phenol là gì?
Phenol là hợp chất hữu cơ thơm có công thức phân tử C6H5OH. Mỗi phân tử bao gồm một nhóm phenyl (-C6H5) liên kết với một nhóm hydroxyl (-OH). Nó là một hóa chất độc, hơi chua nên không được dùng trong thực phẩm và phải hết sức cẩn thận vì có thể gây bỏng nặng.
5.2. Nguồn gốc:
‐ Năm 1834, người ta phát hiện ra phenol khi chiết xuất từ nhựa than đá.
‐ Tiếp đó Joseph Lister đã sử dụng phenol làm chất khử trùng.
‐ Từ năm 1939 cho đến những ngày cuối cùng của Thế chiến II, Đức quốc xã đã sử dụng phenol như một phương tiện để giết người.
‐ Ngày nay, phenol được ứng dụng trong nhiều lĩnh vực khác nhau.
5.3. Tính chất vật lí:
‐ Là chất rắn, ở dạng tinh thể, không màu, có mùi đặc trưng và dễ bay hơi.
‐ Phenol để lâu ngoài không khí sẽ chuyển sang màu hồng do bị oxi hóa một phần và nóng chảy do hấp thụ hơi nước.
‐ Nó hòa tan kém trong nước lạnh, hòa tan trong nước nóng và một số hợp chất hữu cơ. Chúng hòa tan vô hạn ở nhiệt độ trên 66⁰C.
5.4. Điều chế phenol:
Phenol đầu tiên được chiết xuất từ nhựa than đá, nhưng ngày nay do nhu cầu tăng, phenol được sản xuất với số lượng lớn (khoảng 7 tỷ kg/năm) từ dầu mỏ làm nguồn nguyên liệu chính. Nguồn chính của phenol thu được từ quá trình chưng cất than. Ngoài ra, benzen có thể được sử dụng để điều chế phenol.
C6H6 + Br2 → C6H5Br + HBr (xúc tác bột Fe)
C6H5Br + 2NaOH(đặc) → C6H5ONa + NaBr + H2O (nhiệt độ và áp suất cao)
C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3
5.5. Ứng dụng của phenol:
‐ Trong công nghiệp dẻo: là nguyên liệu quan trọng trong sản xuất nhựa phenol formaldehyde.
‐ Hóa chất ngành tơ tằm: Tơ poliamit có thể được tổng hợp từ phenol.
‐ Trong nông dược: là nguyên liệu để sản xuất thuốc diệt cỏ hoặc kích thích tố thực vật 2,4-D.
‐ Được sử dụng để sản xuất một số thuốc nhuộm và chất nổ (axit picric).
‐ Ngoài ra, do khả năng tiêu diệt vi khuẩn, phenol còn được sử dụng trực tiếp như một chất khử trùng, khử trùng hoặc diệt nấm.