Mục lục bài viết
1. Thành phần các chất trong phản ứng:
1.1. Propan là gì:
C3H8 là công thức hóa học của Propan hoặc gas propan. Đây là một hợp chất hydrocacbon no, mạch hở, có khối lượng Mol: 44g/mol.
Ở điều kiện nhiệt độ, áp suất chuẩn, Propan tồn tại ở dạng khí. Hơn nữa, nó có thể nén thành dạng Propan lỏng để dễ dàng vận chuyển và lưu trữ.
Propan là sản phẩm phụ được sinh ra từ quá trình xử lý khí tự nhiên và quá trình lọc dầu. Do đó chúng thường được dùng làm nhiên liệu cho các ứng dụng nhiệt.
C3H8 được lưu giữ và bảo quản ở mức áp suất tương tự chất lỏng trong các bình khí propan. Vì vậy mà chứng dễ trở lại dạng hơi khi bạn giải phóng mức áp suất trong bình khí.
Phương trình để tạo ra chất C3H8 (Propan):
2H2 + C3H4 → C3H8
H2 + C3H6 → C3H8
CH3Cl + 2Na + C2H5Cl → 2NaCl + C3H8
1.2. Metan là gì:
– Trong tự nhiên, metan có nhiều trong các mỏ khí (khí thiên nhiên), trong mỏ dầu (khí mỏ dầu), trong các mỏ than (khí mỏ than).
– Metan có công thức phân tử là CH4 và phân tử khối bằng 16 đvC.
– Metan là chất khí không màu, không mùi, không vị, nhẹ hơn không khí. Tỉ khối của metan với không khí là dCH4/kk = 16/29. Metan rất ít tan trong nước. Nó hóa lỏng ở −162 °C, hóa rắn ở −183 °C, và rất dễ bắt cháy.
– Metan là nguyên liệu quan trong trong đời sống và sản xuất vì khi cháy nó tạo ra nhiệt lượng lớn. Là nguyên liệu để điều chế H2: CH4 + H2O (t°, xt) → CO2 + H2
– Metan là nguyên liệu để điều chế bột than và nhiều chất khác như metanol, axit axetic, anhydrit axetic…
Phương trình để tạo ra CH4 (metan):
C + 2H2 → CH4
2NaOH + CH2(COONa)2 → CH4 + 2Na2CO3
Xúc tác: CaO Điều kiện khác: nhiệt độ cao
CH3COONa + NaOH → CH4 + Na2CO3
Nhiệt độ: nhiệt độ Xúc tác: CaO
1.3. Etilen là gì:
– Etilen có công thức phân tử: C2H4 và có phân tử khối: 28 đvC
– Etilen là chất khí, không màu, không mùi, nhẹ hơn không khí và ít tan trong nước.
– Tương tự như metan, khi đốt khí etilen cháy tạo thành khí CO2, hơi nước và tỏa nhiều nhiệt.
– Etilen dùng để điều chế axit axetic, rượu etylic, poli (vinyl clorua), …
– Etilen dùng kích thích quả mau chín.
Phương trình để tạo ra C2H4 (etilen):
C2H6 → C2H4 + H2
Nhiệt độ: 500°C Xúc tác: xúc tác
C2H5OH → C2H4 + H2O
Nhiệt độ: 170°C Xúc tác: H2SO4
C2H5Cl → C2H4 + HCl
Dung môi: dd NaOH / C2H5OH
2. Điều kiện xảy ra phản ứng:
– Nhiệt độ cao.
– Xúc tác: Ni, Fe, Cr2O3, Pt…
Dưới tác dụng của nhiệt cao và có xúc tác thích hợp C3H8 có thể bị phân hủy thành CH4 và C2H4
– Nhận biết: Dẫn hỗn hợp sản phẩm thu được qua bình đựng dung dịch Brom thấy dung dịch Brom bị nhạt màu.
3. Phản ứng Cracking:
– Phản ứng trên được gọi là phản ứng cracking, ngoài CH4 và C2H4 sản phẩm sinh ra có thể có cả H2 và C3H6.
– Trong điều kiện có nhiệt độ, áp suất cao và xúc tác thì ankan có thể bị bẻ gãy mạch C tạo thành các ankan và anken nhỏ hơn được gọi là phản ứng cracking
– Dù phản ứng xảy ra theo hướng nào thì phản ứng không làm thay đổi khối lượng hỗn hợp: mtrước phản ứng = msau phản ứng.
– Phản ứng luôn làm tăng số mol khí: nsau > ntrước
– Một số phản ứng cracking thường gặp
Phản ứng cracking butan C4H10
Khi thực hiện phản ứng cracking butan thì sẽ thu được hỗn hợp gồm các ankan và anken như: C4H8, H2, CH4, C3H6, C2H6, C2H4,…
Phương trình phản ứng:
C4H10 → C4H8+ H2
C4H10→ CH4 + C3H6
C4H10 → C2H6+ C2H4
C4H10 → C3H8 + CH2
– Phương pháp giải bài tập Cracking Ankan:
Dưới tác dụng của nhiệt độ, xúc tác, ankan có thể phản ứng theo nhiều hướng:
Phản ứng crackinh: ANKAN −tº, xt→ ANKAN KHÁC + ANKEN (làm mất màu dd brom)
Phản ứng đề hydro hóa: ANKAN −tº, xt→ ANKEN + H2
Ví dụ:
C3H8 −tº, xt→ CH4 + C2H4 (CH2=CH2)
C3H8 −tº, xt→ C3H6 (CH2=CH–CH3) + H2
Đặc biệt, trong điều kiện thích hợp phản ứng còn có thể:
+ Tạo ra ankin: Ví dụ: 2CH4 −1500ºC, lln→ CH≡CH + 3H2
+ Tạo ra cabon và hydro: Ví dụ: CH4 −tº, xt→ C (rắn) + 2H2
– Phản ứng không làm thay đổi khối lượng hỗn hợp:
mtrước phản ứng = msau phản ứng ⇒ Mđ/Ms = ns/nđ
hàm lượng C và H trước và sau phản ứng là như nhau ⇒ đốt cháy hỗn hợp sau phản ứng được qui về đốt cháy hỗn hợp trước phản ứng.
– Phản ứng luôn làm tăng số mol khí: nsau > ntrước ⇒ Psau > Pđầu ⇒ Mtb sau < Mtb đầu (vì mđầu = msau)
Ví dụ: C3H8 −tº, xt→ CH4 + C2H4 ⇒ nsau = 2. Nđầu
– Số mol anken sinh ra : nanken = ns – nđ; Hiệu suất phản ứng: H = (ns– nđ)/nđ .100%
4. Bài tập liên quan và lời hướng dẫn:
1. Cracking C3H8 thu được hỗn hợp X gồm H2, C2H4, CH4, C3H6, C3H8 có dX/He = 10. Hiệu suất phản ứng là:
A. 10%
B. 80%.
C. 70%.
D. 60%
Hướng dẫn.
Cracking C3H8:
C3H8 ![]() CH4 + C2H4
CH4 + C2H4
x x x mol
C3H8 ![]() H2 + C3H6
H2 + C3H6
y y y mol
Ta thấy trong X còn lại 1 phần C3H8 chưa bị cracking hết.
MX = MHe.10 = 4.10 = 40 g/mol
Giả sử có 1 mol C3H8.
Bảo toàn khối lượng có: mtrước = msau hay 1.44 = nx.40 → nx = 1,1 mol
Theo các PTHH có nC3H8pư = nsau – ntrước = 1,1 – 1 = 0,1 mol
Vậy 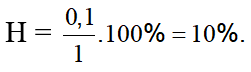
Đáp án: A
2. CH4, C2H4, C3H6 và một phần propan chưa bị craking. Biết hiệu suất phản ứng là 90%. Khối lượng phân tử trung bình của A là:
A. 39,6
B. 23,16
C. 2,315
D. 3,96
Hướng dẫn.
Cracking C3H8:
C3H8 → CH4 + C2H4
C3H8 → H2 + C3H6
Có thể nhận thấy cứ mất 1 mol C3H8 sẽ tạo thành 2 mol sản phẩm. Mà nC3H8 = 0.2 mol
Hiệu suất H = 90%
⇒ số mol sp tạo thành là: 0,2.90%.2 = 0.36 mol;
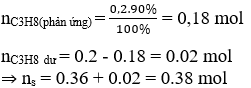
3. CH4, C2H4, C2H6 và một phần propan chưa bị craking. Đốt cháy hoàn toàn A thu được 9 gam H2O và 17,6 gam CO2. Giá trị của m là:
A. 4,4g
B. 6,6g
C. 8,8g
D. 11g
Hướng dẫn
Sản phẩm sinh ra khi đốt cháy A tương tự như đốt cháy propan
npropan = nH2O – nCO2 = 9/18 – 17,6/44 = 0,1 mol
⇒ mpropan = m = 0,1.44 = 4,4 gam
Đáp án A.
4. Công thức tổng quát của ankan là
A. CnHn+2
B. CnH2n+2
C. CnH2n
D. CnH2n-2
Đáp án B
5. Số đồng phân cấu tạo ứng với công thức phân tử C5H12là
A. 6
B. 4
C. 5
D. 3
Hướng dẫn:
Các đồng phân ankan có CTPT C5H12 là:
CH3-CH2-CH2-CH2-CH3
CH3-CH(CH3)-CH2-CH3
C(CH3)4
Vậy có tất cả 3 đồng phân.
Đáp án D
6. Số đồng phân cấu tạo ứng với công thức phân tử C6H14 là
A. 3
B. 4
C. 5
D. 6.
Hướng dẫn:
Viết các đồng phân cấu tạo của C6H14
CH3-CH2-CH2-CH2-CH2-CH3
CH3-CH(CH3)-CH2-CH2-CH3
CH3-CH2-CH(CH3)-CH2-CH3
(CH3)2-CH-CH(CH3)2
(CH3)3-C-CH2-CH3
Vậy C6H14 có 5 đồng phân cấu tạo.
Đáp án: C
7. Hợp chất (CH3)2CHCH2CH2CH3 có tên gọi là
A. neopentan
B. 2- metylpentan
C. ísopentan
D. 1,1- đimetylbutan.
Đáp án: B
8. Ankan (CH3)2CHCH2C(CH3)3 có tên gọi là
A. 2,2,4-trimetylpentan
B. 2,2,4,4-tetrametybutan
C. 2,4,4-trimetylpentan
D. 2,4,4,4-tetrametylbutan
Đáp án: A
9. Ankan X có công thức phân tử C5H12. Clo hóa X, thu được 4 sản phẩm dẫn xuất monoclo. Tên gọi của X là
A. 2,2-đimetylpropan
B. 2- metylbutan
C. pentan
D. 2- đimetylpropan
Đáp án: B
10. Hoàn thành sơ đồ phản ứng sau (viết rõ điều kiện của phản ứng)
C3H8 -> CH4 -> C2H2 -> C2H4 -> C2H6 -> C2H5Cl
Đáp án:
(1) C3H8 -> C2H4 + CH4
(2) 2CH4 -> C2H2 + 2H2
(3) C2H2 + H2 -> C2H4
(4) C2H4 + H2 -> C2H6
(5) C2H6 + Cl2 -> HCl + C2H5Cl
a. Tính hiệu suất phản ứng tạo hh A.
b. Tính giá trị của a.
Giải:
a. Phương trình phản ứng:
C4H10 −tº, xt→ CH4 + C3H6
C4H10 −tº, xt→ C2H6 + C2H4
C4H10 −tº, xt→ H2 + C4H8
Số mol anken thu được: nanken= 35 – 20 = 15mol
Số mol butan ban đầu là: nđ = nbutan = ns – nanken = 35 – 15 = 20 mol
Vậy hiệu suất cracking butan là H = (ns– nđ)/nđ .100% = (35-20)/20.100% = 75%
b. Đốt cháy hỗn hợp A là đốt chay butan:
C4H10 + 11/2O2 → 4CO2 + 5H2O
20 80 mol
Vậy số mol CO2 thu được khi đốt cháy hỗn hợp A là 80 mol





