C2H5ONa + HCl → C2H5OH + NaCl là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem trong bài viết sau.
Mục lục bài viết
1. Phương trình phản ứng C2H5ONa ra C2H5OH:
C2H5ONa + HCl → C2H5OH + NaCl
2. Phân tích Phương trình phản ứng C2H5ONa ra C2H5OH:
2.1. Điều kiện để phản ứng xảy ra:
Điều kiện phản ứng: Nhiệt độ thường
2.2. Các phản ứng tạo ra rượu etylic:
CH3CHO + H2 → C2H5OH
C2H4+ H2O → C2H5OH
C6H12O6 → C2H5OH + CO2
2.3. Tính chất hóa học của HCl:
Dung dịch axit HCl có đầy đủ tính chất hóa học của một axit mạnh.
Tác dụng chất chỉ thị:
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl-
Tác dụng với kim loại:
Tác dụng với kim loại (đứng trước H trong dãy Bêkêtôp) tạo muối với hóa trị thấp của kim loại và giải phóng khí hidro (thể hiện tính oxi).
Fe + 2HCl t⁰> FeCl2 + H2
2Al + 6HCl t⁰> 2AlCl3 + 3H2
Cu + HCl → không có phản ứng
Tác dụng với oxit bazơ và bazơ
Tạo ra sản phẩm muối và nước.
NaOH + HCl → NaCl + H2O
CuO + 2HCl t⁰> CuCl2 + H2O
Fe2O3 + 6HCl t⁰> 2FeCl3 + 3H2O
Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(Dùng để nhận biết gốc clorua)
Ngoài tính chất đặc trưng là axit, dung dịch axit HCl đặc còn đóng vai trò chất khử khi tác dụng với chất oxi hóa mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 t⁰> MnCl2 + Cl + 2H2 O
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan (cường thuỷ) có khả năng hoà tan được Au (vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
3. Bài tập vận dụng liên quan:
Câu 1: Trong phòng thí nghiệm người ta thường dùng phương pháp nào sau đây để điều chế ancol etylic?
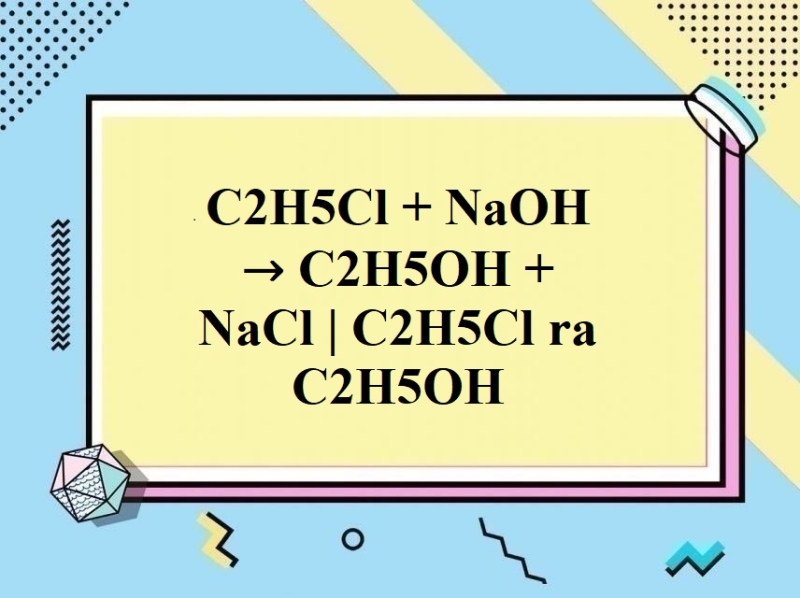
A. Thủy phân dẫn xuất halogen C2H5Cl trong dung dịch kiềm.
B. Hiđrat hóa eten.
C. Đem glucozơ lên men ancol.
D. Cho CH3CHO tác dụng H2 có Ni, đun nóng
Câu 2: Nhận định nào sau đây sai?
A. Có thể dùng glucozơ để sản xuất rượu etylic.
B. Có thể đứng xenlulozo để sản xuất thuốc súng.
C. Phân biệt tinh bột và xenlulozo bằng phản ứng tráng gương.
D. Phân biệt mantozơ và saccarozơ bằng phản ứng tráng gương.
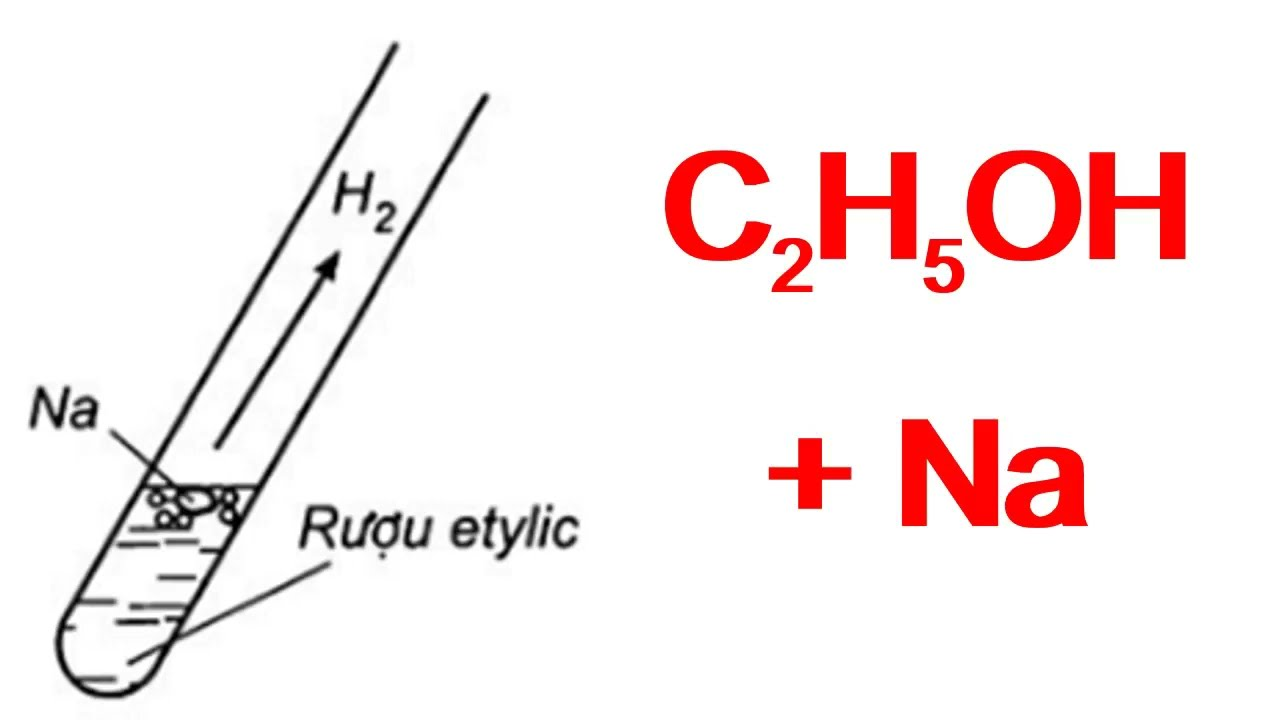
Câu 3: Rượu etylic tác dụng được với Natri vì
A. Trong phân tử có nguyên tử oxi
B. Trong phân tử có nguyên tử hidro và nguyên tử oxi
C. Trong phân tử có nguyên tử cacbon, hidro và nguyên tử oxi
D. Trong phân tử có nhóm -OH.
Câu 4: Ancol etylic không tác dụng với chất nào sau đây?
A. Na.
B. KOH.
C. CH3COOH.
D. O2.
4. Hướng dẫn lời giải:
Câu 1:
Đáp án: A. Thủy phân dẫn xuất halogen C2H5Cl trong dung dịch kiềm.
Câu 2:
Đáp án: C. Phân biệt tinh bột và xenlulozơ bằng phản ứng tráng gương.
Câu 3:
Đáp án: A. Trong phân tử có nguyên tử Oxi.
Trong phân tử rượu etylic có chứa nhóm -OH làm cho rượu có khả năng phản ứng với Na.
Phương trình hóa học:
2C2H5OH + 2Na → 2C2H5ONa + H2↑.
Câu 4:
Đáp án: B. KOH
5. Tìm hiểu thêm về C2H5ONa:
5.1. C2H5ONa là chất gì?
Natri ethoxide là một hợp chất hữu cơ với công thức hóa học C2H5ONa, viết tắt: NaOEt. Hợp chất này xuất hiện dưới dạng bột màu trắng đến hơi vàng, dễ phản ứng với nước nhưng hòa tan trong dung môi phân cực như ethanol. Nó thường được sử dụng như một base mạnh.
5.2. Tính chất vật lí:
‐ C2H5ONa là một chất rắn màu trắng, có tính kiềm mạnh, tan tốt trong nước và cồn.
‐ C2H5ONa có công thức phân tử là C2H5ONa, khối lượng phân tử là 68,05 g/mol, nhiệt độ nóng chảy là 285 °C và nhiệt độ sôi là 400 °C.
‐ C2H5ONa có thể phản ứng với các axit, các hợp chất halogen, các este và các hợp chất cacbonil để tạo ra các sản phẩm khác nhau. C2H5ONa còn được gọi là natri etylat, natri etanolat hay natri etoxit.
5.3. Tính chất hóa học:
C2H5ONa là một muối của axit etylic và natri. Nó có tính chất hóa học tương tự như các muối natri của các axit cacboxylic khác. Nó có thể phản ứng với các axit mạnh để tạo ra axit etylic và muối tương ứng. Nó cũng có thể phản ứng với các halogen để tạo ra các hợp chất hữu cơ halogen hóa. Ngoài ra, nó còn có thể phản ứng với các chất khử như hidro hoặc kim loại để tạo ra etanol và hidroxit natri. C2H5ONa là một chất kiềm mạnh, có khả năng trung hòa các axit yếu và tạo ra muối và nước. Nó cũng có thể làm xà phòng hóa các chất béo và dầu để tạo ra xà phòng và glyxerol.
5.4. Điều chế:
Có rất ít phương pháp để tạo ra dạng rắn khan. Thay vào đó, nó thường được điều chế trong dung môi ethanol. Nó có sẵn trên thị trường dưới dạng dung dịch ethanol. Nó dễ dàng được điều chế trong phòng thí nghiệm bằng phản ứng của natri kim loại với rượu tuyệt đối
2C2H5OH + 2Na → 2C2H5ONa + H2↑
Một phương pháp thay thế rẻ hơn là phản ứng của natri hydroxit với etanol khan. Phản ứng này không hoàn toàn chuyển thành alkoxide, nhưng áp dụng ít khắt khe hơn, điều kiện không thành vấn đề. Sản phẩm muối có thể được tinh chế bằng cách kết tủa trong axeton khan.
5.5. Nhận biết:
Dạng rắn từ từ bị xỉn màu do bị oxy hóa khi bảo quản trong không khí khô. Thủy phân nhanh thành natri hydroxit trong không khí ẩm. Sự chuyển đổi không rõ ràng và mẫu NaOEt có thể được trộn với NaOH.
Natri etoxit thường được sử dụng trong quá trình ngưng tụ Claisen và tổng hợp este malonat. Natri etoxit có thể khử proton phân tử este ở vị trí α để tạo ra phân tử enolate hoặc phân tử este có thể trải qua quá trình thay thế nucleophin gọi là chuyển hóa este. Nếu chất khơi mào là một etyl este, thì sự trao đổi este được coi là không xảy ra vì sản phẩm giống hệt chất khơi mào. Trong thực tế, hỗn hợp dung môi rượu/alkoxit phải phù hợp với thành phần lkoxy của este phản ứng để giảm thiểu các sản phẩm phụ.
Nhiều alkoxit được điều chế bằng phản ứng trao đổi với natri ethoxide.
5.6. Ứng dụng:
C2H5ONa có nhiều ứng dụng trong công nghiệp hóa chất, như là một chất xúc tác, một chất tạo màng, một chất khử và một chất trung hòa. Một số ứng dụng cụ thể của C2H5ONa là:
– Làm chất xúc tác trong phản ứng tạo este từ axit cacboxylic và ancol.
– Làm chất tạo màng trong quá trình sản xuất nhựa epoxy, nhựa polyester và nhựa phenolic.
– Làm chất khử trong phản ứng khử halogenua của các hợp chất hữu cơ.
– Làm chất trung hòa trong phân tích hóa lý, để điều chỉnh độ pH của dung dịch.
6. Tìm hiểu thêm về HCl:
6.1. HCl là gì?
Axit clohydric là một sản phẩm rất quen thuộc trong đời sống và sản xuất hiện đại. Nó là một hợp chất vô cơ có tính axit mạnh, tồn tại ở cả dạng lỏng và khí.
Công thức hóa học của nó là HCl và được biết đến với nhiều tên khác nhau, chẳng hạn như: axit clohydric, axit clohydric, axit muric, chloran.
Nó là một loại axit được sử dụng rộng rãi trong công nghiệp dược phẩm, hóa chất và dược phẩm, nhưng có khả năng ăn mòn mô người, gây tổn thương đường hô hấp, mắt, da và ruột nên được sử dụng hết sức cẩn thận.
6.2. Tính chất vật lí nổi bật:
‐ Khí HCl không màu, mùi hắc, tan tốt trong nước tạo thành dung dịch HCl có tính axit mạnh.
‐ Nó nặng hơn không khí.
‐ Đối với HCl, dung dịch loãng không màu, dung dịch HCl đặc nhất có nồng độ cực đại là 40% và có màu vàng lục. Ở dạng cô đặc, nó có thể tạo thành sương mù axit.
‐ Độ hòa tan trong nước: 725 g / L ở 20 ° C.
‐ Trọng lượng phân tử: 36,5 g / mol.
‐ HCl là dung dịch không dễ bốc cháy nhưng dễ bay hơi.
6.3. Những ứng dụng quan trọng của Axit Clohidric HCl:
‐ Giúp để tẩy gỉ thép để loại bỏ gỉ trên thép bằng nồng độ Axit HCL 18% là phổ biến:
Fe2O3 + Fe + 6 HCl → 3 FeCl2 + 3 H2O
‐ Giúp sản xuất các hợp chất hữu cơ như vinyl clorua và dicloroetan để sản xuất PVC và than hoạt tính:
2 CH2=CH2 + 4 HCl + O2 → 2 ClCH2CH2Cl + 2 H2O
gỗ + HCl + nhiệt → than hoạt tính
‐ Giúp sản xuất các hợp chất vô cơ theo phản ứng oxit bazơ
‐ Giúp kiểm soát và trung hòa PH cụ thể là điều chỉnh tính bazơ trong dung dịch:
OH− + HCl → H2O + Cl−
‐ Được sử dụng để rửa các cation từ nhựa để giúp nước khử khoáng.
‐ Ứng dụng trong tất cả các ngành hóa chất, sản xuất nước uống và một số ngành thực phẩm.
‐ Sử dụng trong sản xuất thực phẩm: các sản phẩm tiêu biểu như aspartame, fructose, citric acid, lysine, protein thực vật thủy phân và gelatin.
‐ Các ứng dụng khác của HCl như: xử lý da, tẩy rửa gia dụng, xây dựng nhà cửa…
‐ Được sử dụng làm chất keo tụ và chất kết tủa để lắng đọng các thành phần trong xử lý nước, sản xuất nước uống, sản xuất giấy và mạ điện trong ngành công nghiệp sơn và pin.
6.4. Điều chế, sản xuất Axit Clohidric như thế nào?
‐ Trong phòng thí nghiệm:
Axit này được điều chế bằng phương pháp sunfat có nồng độ lên đến 40%:
NaCl rắn + H2SO4 đặc → NaHSO4 + HCl (< 2500C)
2NaCl rắn + H2SO4 đặc → Na2SO4 + 2HCl (> 4000C)
‐ Trong công nghiệp:
Axit Clohidric trong công nghiệp được điều chế ở nồng độ phần trăm là 32 -34% bằng phương pháp tổng hợp:
H2 + Cl2 → 2HCl (đun nóng)