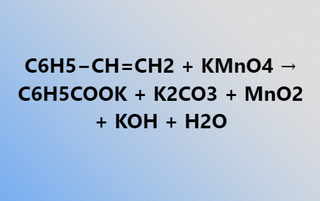
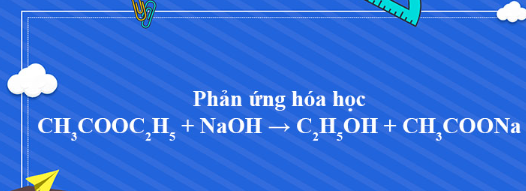
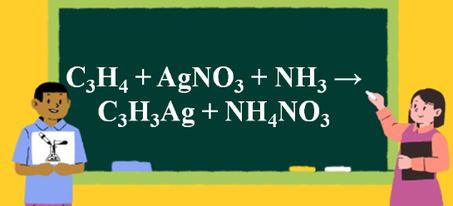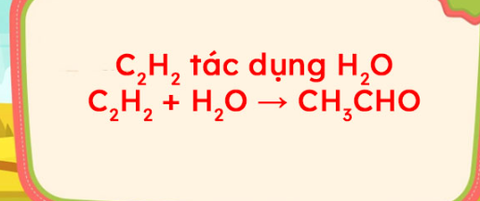C2H5OH + CuO → CH3CHO + Cu + H2O là một phương trình rất khó vận hành trong việc làm các bài tập hóa học. Để giúp các bạn học sinh hiểu rõ hơn và vận hành tốt phương trình này trong làm bài tập trong bài viết này chúng ta sẽ cùng đi vào tìm hiểu về phương trình này.
Mục lục bài viết
1. Phương trình Điều chế CH3CHO từ C2H5OH:
C2H5OH + CuO -> CH3CHO + Cu + H2O
Điều kiện phản ứng xảy ra C2H5OH tác dụng với CuO
Điều kiện xảy ra phản ứng trên phụ thuộc Nhiệt độ
2. Tìm hiểu về C2H5OH và CuO:
2.1. Tìm hiểu về C2H5OH:
a.Khái niệm:
– Định nghĩa: Rượu etylic (rượu etylic hay etanol) là chất lỏng không màu, sôi ở 78,3 độ C, nhẹ hơn nước và tan vô hạn trong nước, tan được nhiều chất như iot, benzen,…
– Công thức phân tử: C2H6O.
b. Tính chất vật lí của rượu etylic:
– Rượu etylic (rượu etylic hay etanol) là chất lỏng không màu, sôi ở 78,3 độ C, nhẹ hơn nước và tan vô hạn trong nước, tan được nhiều chất như iot, benzen,…
-Số ml rượu etylic có trong 100ml hỗn hợp rượu và nước được gọi là rượu
– Ta thấy trong phân tử rượu etylic có nguyên tử hiđro không liên kết với nguyên tử cacbon mà liên kết với nguyên tử oxi tạo thành nhóm -OH. Chính nhóm -OH này mang lại cho ancol những tính chất đặc trưng.
c. Tính chất hóa học của rượu etylic:
Rượu etylic phản ứng mạnh với oxi khi đun nóng.
Rượu etylic tác dụng với natri, giải phóng khí hiđro.
Phản ứng với axit axetic
– Axit axetic tác dụng với rượu etylic tạo ra etyl axetat.
– Etyl axetat là chất lỏng, mùi thơm, ít tan trong nước, được dùng làm dung môi trong công nghiệp.
Sản phẩm của phản ứng giữa ancol và axit được gọi là este.
d.Ứng dụng:
– Dung môi: Ethanol là dung môi phổ biến trong công nghiệp hóa chất do có khả năng hòa tan nhiều chất. Nó được sử dụng để chiết xuất tinh dầu và hương liệu từ thực vật và để tách và tinh chế các hợp chất hữu cơ. Nó cũng được sử dụng trong sản xuất dược phẩm, mỹ phẩm và các sản phẩm chăm sóc cá nhân.
– Nhiên liệu: Ethanol là nhiên liệu sinh học có thể được sản xuất từ các nguồn tái tạo như mía, ngô và lúa mì. Ở nhiều quốc gia, ethanol được trộn với xăng để tạo ra nhiên liệu đốt cháy sạch hơn và hiệu quả hơn xăng nguyên chất, giúp giảm lượng khí thải gây ô nhiễm có hại. Ethanol cũng được sử dụng làm phụ gia nhiên liệu để tăng chỉ số octan và cải thiện hiệu suất động cơ.
– Đồ uống có cồn: Ethanol là thành phần chính trong đồ uống có cồn. Bia, rượu vang và rượu mạnh được sản xuất thông qua quá trình lên men, trong đó men chuyển hóa đường trong ngũ cốc, trái cây hoặc các nguồn carbohydrate khác để tạo ra rượu. Lượng ethanol trong đồ uống có cồn rất khác nhau, trong đó bia thường chứa 4-6% ethanol, rượu vang chứa 8-14% và rượu mạnh chứa 40-50%.
– Sát trùng: Ethanol là chất sát trùng mạnh, có thể tiêu diệt vi khuẩn và vi rút trên da. Nó thường được sử dụng như một thành phần hoạt chất trong chất khử trùng tay và chất khử trùng trong môi trường y tế và phòng thí nghiệm.
– Chất tẩy rửa: Ethanol là chất tẩy rửa hữu ích do khả năng hòa tan các chất hòa tan trong nước và dầu. Nó được sử dụng trong sản xuất điện tử để làm sạch bảng mạch, trong cơ khí chính xác để loại bỏ dầu mỡ và trong ngành công nghiệp ô tô để làm sạch các bộ phận động cơ.
– Chất trung gian hóa học: Ethanol được sử dụng làm nguyên liệu thô trong sản xuất các loại hóa chất khác nhau, chẳng hạn như axit axetic, etyl axetat và etylen. Những hóa chất này được sử dụng trong sản xuất nhựa, sơn phủ, dung môi và các sản phẩm công nghiệp khác.
– Thuốc thử phòng thí nghiệm: Ethanol thường được sử dụng làm môi trường ủ phân và thuốc thử trong môi trường phòng thí nghiệm. Nó được sử dụng trong chiết xuất DNA, kết hợp protein và các quá trình sinh học và sinh hóa khác.
Điều đáng chú ý là trong khi ethanol có nhiều ứng dụng hữu ích, nó cũng rất dễ bắt lửa và có thể gây nguy hiểm nếu hít phải hoặc hít phải một lượng lớn. Cần thực hiện các biện pháp phòng ngừa an toàn thích hợp khi xử lý và lưu trữ etanol, và nó phải luôn được sử dụng theo các quy định và hướng dẫn có liên quan.
2.2. Tìm hiểu về CuO:
a.Khái niệm:
CuO, còn được gọi là Đồng oxit, là một hợp chất cơ bản của Đồng. Một hợp chất khá phổ biến, được tạo thành từ Đồng (Cu) và nguyên tố Oxy (O).
– Công thức phân tử của Đồng oxit: CuO
– Công thức cấu tạo của Đồng Oxit: Cu=O
b.Tính chất vật lí:
CuO là chất rắn, dạng bột màu đen (Kích thước hạt này có bán trên thị trường trong khoảng 30-50 nm). Vì là chất rắn nên CuO không tan trong nước. Ngoài ra, chyar nóng ở nhiệt độ cao (khoảng 1448 độ C).
+ Cách nhận biết: Dẫn khí H2 qua bột đồng oxit có màu đen, nóng. Sau đó để một lúc thấy xuất hiện chất rắn màu đỏ (màu đỏ là đồng Cu).
H2 + CuO —> H2O + Cu
c.Tính chất hóa học:
– Mang lại đây tất cả các tính chất hóa học của bazơ đồng
– Ngoài ra, nó dễ dàng bị loại bỏ bởi kim loại đồng
– Phản ứng với axit
Vì là gốc Đồng nên Đồng Oxi (CuO) có khả năng phản ứng với axit. Chẳng hạn, cụ thể như sau:
+ CuO + 2HCl → CuCl2 + H2O
+ CuO + 2HNO3 → Cu(NO3)2 + H2O
– Phản ứng với oxit axit
Ngoài axit, CuO còn có thể phản ứng với hợp chất oxit axit
+3CuO + P2O5 → Cu3(PO4)2
-Phản ứng với các chất khử mạnh H1, C, CO…
Điều đặc biệt của oxit bazơ này là nó còn có thể phản ứng với các chất khử mạnh. Cụ thể, thể hiện qua các phương thức sau:
+H2 + CuO —-> H2O + Cu
+CO + CuO—-> CO2 + Cu
– Cách điều chế Đồng Oxit (CuO)
Một trong những cách chính để điều chế Đồng Oxit là đốt cháy Đồng trong Oxy. phương trình:
+Cu + O2 —> CuO
d. Ứng dụng của Đồng Oxit (CuO):
Ứng dụng phổ biến nhất của Đồng Oxit là dùng cho công nghệ trang trí và gia công kính.
Vì là hợp chất oxit bazơ nên CuO không bị oxi hóa trong không khí ở nhiệt độ thường và cũng không bị đổi màu nên được dùng làm chất tạo màu trong công nghiệp gốm sứ. Tạo cho sản phẩm có ánh xanh trong lớp men của sản phẩm rất đẹp và tinh tế.
Ngoài ra, oxit đồng được biết đến là một từ thông khá mạnh. Điều này giúp nó tăng nhiệt độ đàn ông nóng bỏng và tăng khả năng cuồng nhiệt do hệ thống số giãn ra trong điều kiện nhiệt độ cao.
Đặc biệt, CuO trong men bari/thiếc/natri cho màu xanh lam. K2O có thể làm cho men với CuO chuyển sang màu vàng.
3. Câu hỏi bài tập liên quan :
Câu 1: Cho các nhận định dưới đây:
(a) Axit axetic có khả năng phản ứng được với ancol metylic, metylamin và Mg kim loại.
(b) Độ pH của glyxin nhỏ hơn đimetylamin.
(c) Dung dịch metylamin và axit glutamic đều làm hồng dung dịch phenoltalein.
(d) CH5N có số đồng phân cấu tạo nhiều hơn CH4O.
Số nhận định đúng là
A. 1.
B. 3.
C. 4.
D. 2.
Đáp án D
Giải thích:
(a) Đúng:
CH3COOH + CH3OH ⇄ CH3COOCH3 + H2O (xt: H2SO4 đặc, to)
CH3COOH + CH3NH2 → CH3COOH3NCH3
2CH3COOH + Mg → (CH3COO)2Mg + H2
(b) Đúng vì Glyxin có pH = 7 và metylamin có pH > 7.
(c) Sai vì Glu có pH < 7 nên không làm đổi màu phenolphtalein.
(d) Sai vì đều có 1 đồng phân cấu tạo (CH3NH2và CH3OH).
⇒ (a) và (b ) đúng
Câu 2. Hợp chất A chứa C, H, O có M < 90 đvC. A tham gia phản ứng tráng bạc và có thể tác dụng với H2 (xt, Ni) sinh ra ancol chứa C bậc IV trong phân tử. Công thức của A là công thức nào sau đây:
A. (CH3)2CHCHO.
B. (CH3)2CH-CH2CHO.
C. (CH3)3C-CH2CHO.
D. (CH3)3CCHO.
Đáp án D
Giải thích:
A có khả năng tráng bạc => A chứa gốc –CHO
Ancol chứa C bậc IV => có dạng (CH3)3C-R-CHO
Vì M < 90 => 57 + R + 29 < 90 => R = 0
Vậy kết luận A có công thức hóa học là (CH3)3CCHO.
Câu 3. Cho Các các nhận định sau đây
(a) Chất béo là trieste của glixerol và các axit béo.
(b) Chất béo nhẹ hơn nước, không tan trong nước nhưng tan nhiều trong dung môi hữu cơ.
(c) Phản ứng thủy phân chất béo trong môi trường kiềm gọi là phản ứng xà phòng hóa.
(d) Các este đều được điều chế từ axit cacboxylic và ancol.
(e) Tristearin, triolein có công thức lần lượt là: (C17H33COO)3C3H5, (C17H35COO)3C3H5.
(f) Tất cả các peptit có phản ứng màu với Cu(OH)2/OH-.
(g) Dung dịch saccarozơ không tham gia phản ứng tráng bạc.
Số nhận định đúng là bao nhiêu nhận định:
A. 2.
B. 4.
C. 5.
D. 3.
Đáp án B
Câu 4. Trong các chất dưới đây, chất nào có nhiệt độ sôi cao nhất?
A. CH3CH2OH.
B. CH3COOH.
C. CH3CHO.
D. CH3CH3.
Đáp án B
Câu 5. Nhỏ từ từ dung dịch axit axetic vào cốc đựng một mẩu đá vôi ta thấy hiện tượng:
A. Mẩu đá vôi tan dần do axit axetic mạnh hơn axit cacbonic, không thấy có khí thoát ra.
B. mẩu đó vôi tan dần do axit axetic mạnh hơn axit cacbonic, thấy có khí không màu thoát ra.
C. Mẩu đá vôi tan dần, thấy có khí màu lục nhạt thoát ra.
D. mẩu đá vôi không thay đổi do axit axetic yếu hơn axit cacbonic
Đáp án B