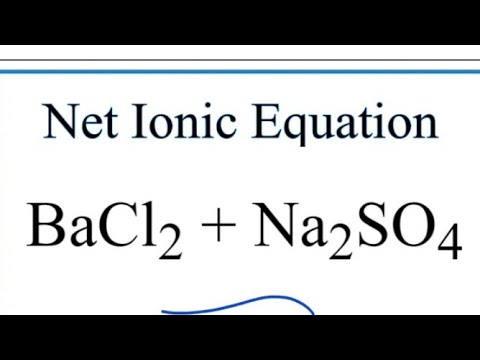Phản ứng giữa BaCl2 và H2SO4 là phản ứng trao đổi ion trong đó các ion Cl- và SO42- hoán đổi để tạo ra BaSO4 kết tủa và axit clohiđric HCl được giải phóng. Bên cạnh đó, phản ứng này còn được sử dụng trong việc tách kết tủa và trong phân tích hóa học.
Mục lục bài viết
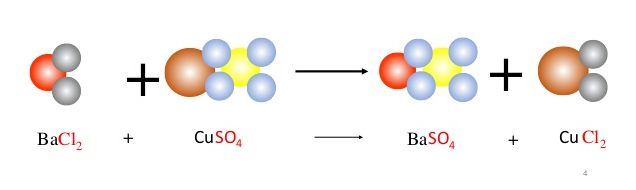
1. Phương trình phản ứng BaCl2 tác dụng H2SO4L
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
2. Điều kiện phản ứng BaCl2 tác dụng H2SO4:
Điều kiện phản ứng: Nhiệt độ thường
2.1. Cách tiến hành phản ứng BaCl2 tác dụng với H2SO4:
Để tiến hành phản ứng này, đầu tiên chúng ta cần chuẩn bị một ống nghiệm. Sau đó, từ từ từng giọt H2SO4 sẽ được thêm vào ống nghiệm chứa sẵn BaCl2. Việc thêm từng giọt H2SO4 một cách chậm và từ từ sẽ giúp đảm bảo rằng phản ứng diễn ra chậm và an toàn hơn. Nếu muốn đảm bảo an toàn, bạn có thể sử dụng bình hút khí để thêm H2SO4 vào ống nghiệm.
2.2. Hiện tượng xảy ra sau phản ứng BaCl2 tác dụng H2SO4:
Khi hợp chất BaCl2 phản ứng với H2SO4, sẽ xảy ra một hiện tượng thú vị. Sau khi phản ứng diễn ra, bạn sẽ thấy một kết tủa trắng mịn bám trên thành của lọ thí nghiệm. Kết tủa này được hình thành từ hợp chất BaSO4.
Điều thú vị là hiện tượng này có thể được sử dụng để xác định nồng độ của hợp chất BaCl2 trong một mẫu. Bằng cách sử dụng phương pháp này, chúng ta có thể tính được số mol của hợp chất BaCl2 trong mẫu bằng cách đo khối lượng của kết tủa BaSO4. Từ đó, chúng ta có thể tính toán được nồng độ của hợp chất BaCl2 trong mẫu.
Ngoài ra, kết tủa trắng mịn của hợp chất BaSO4 cũng có thể được sử dụng để xác định nồng độ của hợp chất H2SO4 trong một mẫu. Bằng cách sử dụng phương pháp này, chúng ta có thể tính được số mol của hợp chất H2SO4 trong mẫu bằng cách đo khối lượng của kết tủa BaSO4. Từ đó, chúng ta có thể tính toán được nồng độ của hợp chất H2SO4 trong mẫu.
Ngoài ra, kết tủa BaSO4 còn được sử dụng để tẩy nước và loại bỏ các chất gây ô nhiễm như As, Pb và Cd trong nước. Khi kết tủa được hình thành, chúng ta có thể lọc bỏ nó khỏi nước, từ đó làm sạch nước.
Cuối cùng, kết tủa BaSO4 còn được sử dụng trong việc sản xuất các vật liệu chống cháy. Kết tủa này có tính chất chống cháy và được sử dụng để tạo ra các vật liệu chịu lửa trong ngành công nghiệp.
3. Cách viết phương trình ion thu gọn của phản ứng BaCl2 tác dụng với H2SO4:
3.1. Phương trình hóa học BaCl2 + H2SO4:
Đây là một phản ứng trao đổi, trong đó muối clohydric của axit sunfuric và muối kết tủa của sunfat bari được tạo ra. Để giải quyết bài toán, chúng ta có thể làm theo các bước sau:
Bước 1: Viết phương trình phân tử
Phương trình phân tử cho phản ứng này được viết như sau:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Bước 2: Viết phương trình ion đầy đủ
Tiếp theo, ta sẽ viết phương trình ion đầy đủ bằng cách chuyển các chất vừa dễ tan, vừa điện li mạnh thành ion và giữ nguyên các chất điện li yếu, chất kết tủa, chất khí dưới dạng phân tử:
Ba2+ + 2Cl- + 2H+ + SO42- → BaSO4↓ + 2H+ + 2Cl-
Bước 3: Viết phương trình ion thu gọn
Cuối cùng, chúng ta sẽ viết phương trình ion thu gọn từ phương trình ion đầy đủ bằng cách lược bỏ đi các ion giống nhau ở cả hai vế:
Ba2+ + SO42- → BaSO4↓
Qua các bước trên, chúng ta đã có phương trình hóa học cho phản ứng trao đổi giữa BaCl2 và H2SO4. Việc giải quyết bài toán sẽ dựa trên phương trình này.
3.2. Phương trình ion rút gọn:
Ba2+ + SO42- → BaSO4 ↓
4. Mở rộng về phản ứng trao đổi trong dung dịch chất điện li:
Khi hai dung dịch hỗn hợp phản ứng với nhau, chúng sẽ tạo thành một sản phẩm mới. Việc xác định được sản phẩm mới được tạo ra trong phản ứng trao đổi ion là rất quan trọng và có tính ứng dụng rất cao trong ngành hóa học. Phản ứng trao đổi ion thường xảy ra giữa các ion trong dung dịch. Tuy nhiên, phản ứng này chỉ xảy ra khi các ion kết hợp được với nhau để tạo thành ít nhất một trong ba loại chất sau đây: chất kết tủa, chất điện li yếu hoặc chất khí.
Nói cách khác, phản ứng trao đổi ion là quá trình tạo ra các chất mới thông qua việc trao đổi các ion giữa hai chất. Các ion trong dung dịch sẽ tương tác với nhau và tạo thành các liên kết mới để tạo ra sản phẩm mới. Việc chọn các chất ban đầu để phản ứng cũng rất quan trọng vì nó ảnh hưởng đến sản phẩm cuối cùng được tạo ra.
Ví dụ, phản ứng giữa Na2SO4 và BaCl2 sẽ tạo ra hai chất mới là NaCl và BaSO4. Trong khi đó, phản ứng giữa HCl và NaOH sẽ tạo ra NaCl và H2O. Cuối cùng, phản ứng giữa Fe và H2SO4 loãng sẽ tạo ra FeSO4 và H2 khí thoát ra. Tóm lại, phản ứng trao đổi ion có thể tạo ra nhiều loại sản phẩm khác nhau và phụ thuộc vào các chất ban đầu được sử dụng.
Việc hiểu rõ về phản ứng trao đổi ion rất quan trọng, đặc biệt là trong lĩnh vực hóa học. Nó có thể được sử dụng để tạo ra các sản phẩm mới, cũng như để giải quyết các vấn đề liên quan đến môi trường, năng lượng và y tế. Ngoài ra, việc hiểu về phản ứng trao đổi ion cũng giúp ta hiểu rõ hơn về cấu trúc và tính chất của các chất hóa học, đồng thời mở ra nhiều cánh cửa nghiên cứu mới trong ngành hóa học.
5. Bài tập vận dụng liên quan:
Câu 1. Điện phân dung dịch NaCl bão hoà, có màng ngăn giữa hai điện cực, sản phẩm thu được là:
A. NaOH, H2, Cl2
B. NaCl, NaClO, H2, Cl2
C. NaCl, NaClO, Cl2
D. NaClO, H2 và Cl2
Đáp án A
Câu 2. Để nhận biết 3 lọ mất nhãn đựng 3 dung dịch CuCl2, FeCl3, MgCl2 ta dùng:
A. Quỳ tím
B. Dung dịch Ba(NO3)2
C. Dung dịch AgNO3
D. Dung dịch KOH
Đáp án D
Khi làm việc với các loại hóa chất, việc đánh dấu nhãn cho từng loại dung dịch là rất quan trọng để tránh nhầm lẫn và các tai nạn không đáng có. Tuy nhiên, đôi khi ta có thể bị mất nhãn cho các lọ dung dịch và không biết chúng là gì. Trong trường hợp này, chúng ta có thể sử dụng một số phương pháp đơn giản để xác định chính xác các loại dung dịch mà không cần phải dựa vào nhãn.
Một trong những phương pháp đó là sử dụng dung dịch KOH để tạo ra các kết tủa có màu khác nhau. Cụ thể, để nhận biết 3 lọ dung dịch mất nhãn đựng 3 dung dịch CuCl2, FeCl3, MgCl2, ta sử dụng dung dịch KOH như sau:
Đầu tiên, để nhận biết dung dịch CuCl2, ta thêm dung dịch NaOH vào. Phản ứng sẽ tạo ra kết tủa xanh được mô tả như sau: CuCl2 + 2NaOH → Cu(OH)2 ↓xanh + 2NaCl
Tiếp theo, để nhận biết dung dịch FeCl3, ta thêm dung dịch NaOH vào. Phản ứng sẽ tạo ra kết tủa đỏ nâu được mô tả như sau: FeCl3 + 3NaOH → Fe(OH)3 ↓đỏ nâu + 3NaCl
Cuối cùng, để nhận biết dung dịch MgCl2, ta thêm dung dịch NaOH vào. Phản ứng sẽ tạo ra kết tủa trắng được mô tả như sau: MgCl2 + 2NaOH → Mg(OH)2↓trắng + 3NaCl
Ngoài ra, ta còn có thể sử dụng các phương pháp khác như sử dụng độ dẫn điện hoặc các phương pháp phân tích hóa học để xác định chính xác các loại dung dịch. Tuy nhiên, phương pháp sử dụng dung dịch KOH là một phương pháp đơn giản và hiệu quả để giúp nhận biết các loại dung dịch mất nhãn.
Câu 3. Dung dịch của chất X có pH >7 và khi cho tác dụng với dung dịch kali sunfat( K2SO4) tạo ra chất không tan (kết tủa). Chất X là:
A. BaCl2
B. NaOH
C. Ba(OH)2
D. H2SO4
Đáp án C
Dung dịch chất X có pH lớn hơn 7, do đó X được xếp vào loại bazơ. Vì vậy, chúng ta có thể loại bỏ lựa chọn A và D.
Chúng ta còn biết rằng dung dịch X có khả năng tác dụng với dung dịch K2SO4 để tạo ra kết tủa. Từ đó, chúng ta suy ra được rằng chất X có thể là Ba(OH)2.
Công thức hóa học cho phản ứng giữa Ba(OH)2 và K2SO4 là: Ba(OH)2 + K2SO4 → BaSO4 ↓ + 2KOH. Ở đây, Ba(OH)2 phản ứng với K2SO4 để tạo ra kết tủa BaSO4 và dung dịch KOH.
Câu 4. Cho dung dịch KOH vào ống nghiệm đựng dung dịch FeCl3, hiện tượng quan sát được là:
A. Có kết tủa trắng xanh.
B. Có khí thoát ra.
C. Có kết tủa đỏ nâu.
D. Kết tủa màu trắng.
Đáp án C
Phương trình hóa học phản ứng trên cho thấy sự tương tác giữa các chất. Khi cho dung dịch KOH vào ống nghiệm chứa dung dịch FeCl3, ta quan sát được hiện tượng kết tủa Fe(OH)3 màu nâu đỏ. Điều này cho thấy rằng phản ứng đã xảy ra giữa hai chất này và sản phẩm cuối cùng là Fe(OH)3 và KCl. Phản ứng này có thể được sử dụng để tạo ra các sản phẩm mới hoặc để tìm hiểu về tính chất của các chất hóa học. Ngoài ra, còn có thể sử dụng phương trình hóa học phản ứng này để giải quyết các vấn đề trong lĩnh vực y tế, môi trường, công nghiệp và nhiều lĩnh vực khác.