Ankan là một nhóm chất hữu cơ cơ bản trong chương trình Hóa học lớp 11. Để hiểu rõ hơn về hợp chất quan trọng này, hãy cùng tìm hiểu những lý thuyết trọng tâm bao gồm định nghĩa, tính chất, ứng dụng và cách điều chế của ankan trong bài viết dưới đây.
Mục lục bài viết
1. Ankan là gì?
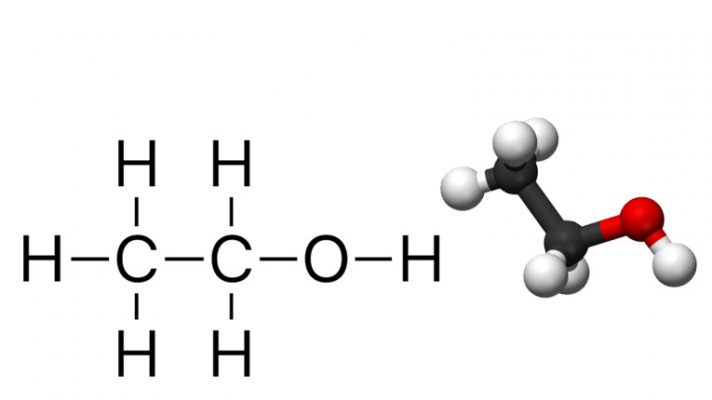
Alkan hay còn gọi là Ankan hoặc Alkane. Alkan trong hóa học là một lớp các hydrocarbon no (không có liên kết đôi hoặc ba giữa các nguyên tử cacbon) mà các nguyên tử cacbon được kết nối bởi liên kết đơn. Công thức chung của một hydrocarbon no có dạng CnH2n+2, trong đó “n” là số nguyên tử cacbon.
Các ví dụ phổ biến về alkan bao gồm metan (CH4), etan (C2H6), propan (C3H8), butan (C4H10), và nhiều hợp chất cacbon khác có cùng cấu trúc hạt nhân.
Alkan là một phần quan trọng của hóa học hữu cơ và là một phần chính của dầu mỏ và các dẫn xuất của nó. Cấu trúc đơn giản và bền của các alkane khiến chúng trở thành các phân tử cơ bản trong nhiều quá trình hóa học và công nghiệp, cũng như là một phần quan trọng của nhiều sản phẩm dầu mỏ và khí tự nhiên.
Ankan là một loại hợp chất hữu cơ thuộc nhóm ankan, có công thức phân tử là CnH2n+2 (n ≥ 1), trong đó n là số nguyên dương. Ankan có cấu trúc phân tử gồm các nguyên tử carbon liên kết với nhau bằng các liên kết đơn, và mỗi nguyên tử carbon liên kết với hai hoặc ba nguyên tử hydro.
Ankan có thể được phân loại theo số lượng nguyên tử carbon trong phân tử. Ankan đơn giản chỉ có một nguyên tử carbon là metan (CH4), ankan đơn vị có hai nguyên tử carbon là etan (C2H6), ankan ba đơn vị có ba nguyên tử carbon là propan (C3H8), và cứ thế tăng lên theo quy tắc IUPAC. Ankan cũng có thể có cấu trúc phân nhánh, nghĩa là có một hoặc nhiều nhóm metyl (-CH3) gắn vào chuỗi chính của ankan. Ví dụ như isobutan (C4H10) có một nhóm metyl gắn vào nguyên tử carbon thứ hai của propan. Ankan cũng có thể có cấu trúc vòng, nghĩa là các nguyên tử carbon liên kết với nhau tạo thành một hình tròn. Ví dụ như xiclopropan (C3H6) có ba nguyên tử carbon liên kết với nhau tạo thành một tam giác đều.
2. Tính chất vật lý và tính chất hóa học của Alkan:
2.1. Tính chất vật lý:
Alkan có một số tính chất vật lý quan trọng, bao gồm:
- .Tính chất động học: Alkan thường có các liên kết C-C và C-H đơn, do đó chúng thường rất bền và không dễ bị phân tách. Tính bền này làm cho alkan dễ lưu trữ và sử dụng.
- Trạng thái vật lý: Các alkane có thể tồn tại ở nhiều trạng thái khác nhau, bao gồm khí (ví dụ: metan và etan ở điều kiện tiêu chuẩn), chất lỏng (ví dụ: propan và butan) hoặc chất rắn (ví dụ: các dẫn xuất dài hơn như hexan trở lên).
- Khả năng phân tách: Alkan không hòa tan trong nước, do đó chúng thường phân tách dễ dàng với nước. Điều này tạo điều kiện thuận lợi cho quá trình như trích ly và tách hợp chất từ các hỗn hợp.
- Điểm nóng chảy và sôi: Các alkane có điểm nóng chảy và điểm sôi tăng theo độ dài của chuỗi cacbon. Chẳng hạn, metan có điểm sôi thấp (-161,5 °C) và butan có điểm sôi cao hơn (0 °C).
- Khả năng dẫn điện: Alkan là các hợp chất cơ học không dẫn điện, vì chúng không chứa các nguyên tố kim loại hoặc nguyên tố có khả năng dẫn điện.
Tính chất vật lý của một alkane cụ thể sẽ phụ thuộc vào số lượng các nguyên tử cacbon trong chuỗi cacbon và môi trường nhiệt độ, áp suất và khí quyển trong quá trình xem xét.
2.2. Tính chất hóa học:
– Trong nhiệt độ thường, các ankan không tác dụng với dung dịch axit, dung dịch kiềm và các chất oxi hóa.
– Khi được đun nóng hoặc chiếu sáng, các ankan dễ dàng tham gia các phản ứng thế, phản ứng tách hidro và phản ứng cháy.
– Phản ứng thế là phản ứng mà một nguyên tố hoạt động hóa học mạnh hơn trong hợp chất sẽ thay thế nguyên tố hoạt động hóa học yếu hơn. Ankan có thể bị thế một hoặc nhiều nguyên tử hydro bằng các nhóm chức khác như halogen, nitro, sunfonic, hydroxyl,… Phản ứng thế thường xảy ra khi ankan tác dụng với các chất oxi hóa mạnh như Cl2, Br2, HNO3, H2SO4,…
Phản ứng thế có công thức tổng quát như sau:
CnH2n+2 + xX2 → CnH2n+2-xXx + xHX
Trong đó X là halogen, HX là axit halohydric.
Phản ứng thế của ankan có thể xảy ra theo cơ chế gốc tự do – dây chuyền gồm 3 giai đoạn: khơi mào, phát triển và tắt mạch. Phản ứng thế cũng phụ thuộc vào bậc của nguyên tử cacbon trong phân tử ankan. Bậc của nguyên tử C được tính bằng số liên kết của chính nó với các nguyên tử C khác. Khả năng phản ứng của các nguyên tử C trong ankan là: Cbậc 3 > Cbậc 2 > Cbậc 1.
Ví dụ: CnH2n+2 + xCl2 → CnH2n+2-x Clx + xHCl (x ≤ 2n+2).
– Phản ứng tách hidro (cracking) là phản ứng mà ankan bị tách thành các hiđrocacbon không no và hidro. Ankan có thể bị tách thành các ankan nhỏ hơn hoặc các hidrocacbon không no khác. Phản ứng tách thường xảy ra khi ankan được gia nhiệt ở nhiệt độ cao hoặc có xúc tác.
Phương trình tổng quát của phản ứng là:
CnH2n+2 → CnH2n + H2
Trong phản ứng này, hai nguyên tử hidro gắn với hai nguyên tử cacbon liền kề nhau sẽ tách ra cùng nhau, tạo ra một liên kết pi giữa hai nguyên tử cacbon đó. Phản ứng này chỉ xảy ra với những ankan có từ hai nguyên tử cacbon trở lên, và ưu tiên tách hidro ở cacbon bậc cao.
Ví dụ: CH4 + Cl2 → CH3Cl + HCl.
– Phản ứng oxi hóa của ankan là phản ứng mà ankan phản ứng với oxi để tạo ra các sản phẩm khác nhau. Phản ứng oxi hóa quan trọng nhất của ankan là phản ứng đốt cháy, trong đó ankan cháy hoàn toàn trong không khí hay oxi tạo ra nước và khí carbon dioxide. Phản ứng này giải phóng nhiều nhiệt và ánh sáng. Phương trình tổng quát của phản ứng đốt cháy ankan có dạng:
CnH2n+2 + (n + n/2)O2 → nCO2 + (n + 1)H2O
Ví dụ: Phản ứng đốt cháy metan (CH4):
CH4 + 2O2 → CO2 + 2H2O
Ngoài ra, ankan cũng có thể bị oxi hóa không hoàn toàn tạo ra các sản phẩm khác như ancol, andehit, xeton, axit carboxylic… Tuy nhiên, phản ứng này yêu cầu nhiệt độ cao hoặc có mặt xúc tác.
Ankan có thể bị oxi hóa thành các sản phẩm khác nhau tùy thuộc vào điều kiện phản ứng. Nếu oxi hóa hoàn toàn, ankan sẽ tạo ra CO2 và H2O. Nếu oxi hóa không hoàn toàn, ankan sẽ tạo ra CO và H2O hoặc C và H2O.
– Phản ứng nhiệt phân của Ankan là phản ứng mà ankan bị tách thành các hidrocacbon nhỏ hơn do tác dụng của nhiệt độ, áp suất và chất xúc tác. Phản ứng này có thể tạo ra các sản phẩm là ankan khác, anken, ankin, benzen, toluen, hidro hoặc các hợp chất halogen hóa. Phản ứng nhiệt phân của Ankan có ý nghĩa quan trọng trong công nghiệp hóa dầu, vì nó giúp chuyển hóa các dầu thô nặng thành các sản phẩm nhẹ hơn có giá trị cao hơn như xăng, dầu diesel, khí tự nhiên.
Ví dụ: C 10 H 22 → C 6 H 14 + C 4 H 8 (phản ứng cracking)
C 6 H 14 → C 6 H 6 + 4H 2 (phản ứng đề hydro hóa)
C 10 H 22 + Cl 2 → C 10 H 21 Cl + HCl (phản ứng halogen hóa)
3. Các cách để điều chế Alkan:
– Để điều chế ankan trong phòng thí nghiệm, người ta thường sử dụng các phương pháp sau:
+ Phản ứng vôi tôi xút: Đun nóng muối của axit cacboxylic với hỗn hợp vôi tôi xút để tạo ra ankan và cacbonat kim loại kiềm. Ví dụ:
CH3COONa + NaOH → CH4 + Na2CO3 (CaO, nhiệt độ)
+ Cộng H2 vào hợp chất không no: Cho hợp chất không no đi qua Ni nóng đỏ để cộng H2 thành ankan. Ví dụ:
C2H4 + H2 → C2H6 (Ni, nhiệt độ)
– Để điều chế ankan trong công nghiệp, có thể sử dụng các phương pháp sau:
+ Chưng cất phân đoạn dầu mỏ: Dầu mỏ được đun nóng ở nhiệt độ cao để tách ra các thành phần khác nhau theo điểm sôi, trong đó có các ankan.
C + 2H2 → CH4 (Ni, 500 độ C)
CO + 3H2 → CH4 + H2O (nhiệt độ, xúc tác)
+ Đi từ khí thiên nhiên và khí dầu mỏ: Khí thiên nhiên và khí dầu mỏ chủ yếu là metan và etan, có thể được sử dụng trực tiếp hoặc tổng hợp thành các ankan khác.
+ Cracking ankan: Đun nóng ankan ở nhiệt độ cao để phân rã thành các ankan nhỏ hơn và các sản phẩm khác. Ví dụ:
C10H22 → C5H12 + C3H8 + C2H2
4. Ứng dụng của Alkan trong cuộc sống:
Các alkane có nhiều ứng dụng quan trọng trong cuộc sống hàng ngày và trong nhiều ngành công nghiệp. Dưới đây là một số ứng dụng chính của các alkane:
- Nhiên liệu hóa thạch: Alkane là thành phần chính của nhiên liệu hóa thạch như xăng, dầu diesel và dầu mỏ. Chúng được sử dụng trong giao thông cá nhân, công nghiệp và nhiều khía cạnh khác của cuộc sống hàng ngày.
- Nhiên liệu đốt: Metan (CH4) là thành phần chính của khí tự nhiên, và nó được sử dụng làm nhiên liệu đốt cho nấu ăn, làm ấm và sản xuất điện.
- Hợp chất hữu cơ: Các alkane dài hơn có thể được sử dụng trong các sản phẩm hóa dầu khác như parafin làm nến, dầu khoáng, và sáp.
- Chất làm lạnh: Butan và các alkane ngắn hơn khác có thể được sử dụng trong các hệ thống làm lạnh và làm nguội.
- Dầu mỹ phẩm: Alkane nhẹ như isohexadecane và isododecane thường được sử dụng trong sản phẩm mỹ phẩm như kem dưỡng da và son môi để tạo sự mềm mịn và không gây kích ứng da.
- Thuốc trừ sâu và chất chống ăn mòn: Các alkane như kerosene có thể được sử dụng trong các sản phẩm như thuốc trừ sâu và chất chống ăn mòn.
- Hóa chất công nghiệp: Alkane có thể được sử dụng trong sản xuất hóa chất công nghiệp như dầu hỏa, dầu cắt và nhiều sản phẩm khác.
- Nhiên liệu tên lửa: Một số alkane ngắn hơn được sử dụng trong nhiên liệu tên lửa.
- Dầu truyền nhiệt: Alkane có thể được sử dụng làm chất truyền nhiệt trong các ứng dụng công nghiệp và quân đội.
Những ứng dụng này chỉ là một số ví dụ, và alkane có mặt trong nhiều khía cạnh của cuộc sống và công nghiệp, từ nhiên liệu đến sản phẩm hóa phẩm và nhiều lĩnh vực khác.