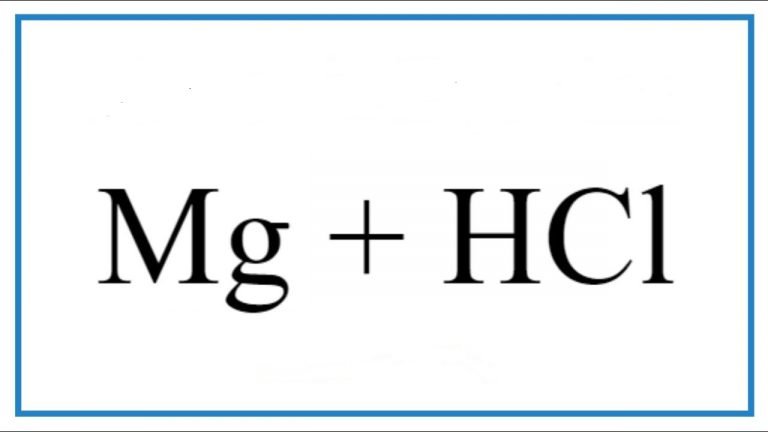Phản ứng giữa nhôm (Al) và axit nitric (HNO3) tạo ra nhôm nitrat (Al(NO3)3), dinitrogen monoxide (NO2), và nước (H2O). Dưới đây là bài viết về chủ đề: Al + HNO3 → Al(NO3)3 + NO2 + H2O | Al ra Al(NO3)3, mời bạn đọc theo dõi.
Mục lục bài viết
1. Cân bằng phương trình hóa học: Al + HNO3 → Al(NO3)3 + NO2 + H2O | Al ra Al(NO3)3:
– Cân bằng số nguyên tử của từng nguyên tố:
Cân bằng số nguyên tử của Al: 1 Al bên trái và 1 Al bên phải, vì vậy Al đã được cân bằng.
Cân bằng số nguyên tử của N: 1 N từ NO_3 và 3 N từ NO_2, tổng cộng 4 N bên phải và 1 N từ HNO_3 bên trái. Do đó, thêm 3 HNO_3 vào bên trái để cân bằng N.
Cân bằng số nguyên tử của O: 9 O từ Al(NO_3)_3, 4 O từ NO_2, và 6 O từ H_2O bên phải. Cần thêm 5 O vào bên trái, do đó thêm 5 H_2O.
– Cân bằng số điện tích:
Số điện tích phải bằng nhau ở cả hai bên của phương trình. Điện tích dương của Al cộng với điện tích âm của các ion NO_3 sẽ bằng số điện tích dương của các ion Al(NO_3)_3. Vì Al(NO_3)_3 có 3 ion NO_3, nên điện tích âm của nó là -3. Vậy nên, Al có thể cân bằng với 3 NO_3 từ bên phải.
Khi đã cân bằng N và O, ta cần thêm 6HNO_3 để cân bằng điện tích, và điều này cũng giúp cân bằng N.
Cuối cùng, phương trình đã được cân bằng là:
Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O