Cho 5,6 gam Fe tác dụng hết với dung dịch HNO3 (dư), sinh ra V lít khí NO2 (ở đktc, sản phẩm khử duy nhất). Tính thể tích khí sinh ra? Là bài tập cơ bản điển hình cho chuyên đề axit nitric. Giúp các bạn nắm được kiến thức đã học vận dụng làm bài tập, tiền đề cho các bài hóa nâng cao Hóa học lớp 11.
Mục lục bài viết
1. Cho 5,6 gam Fe tác dụng hết với dung dịch HNO3 (dư):
Cho 5,6 gam Fe tác dụng hết với dung dịch HNO3 (dư). Sau phản ứng sinh ra V lít khí NO2 (ở đktc, sản phẩm khử duy nhất). Tính thể tích khí sinh ra?
A. 6,72 lít B. 13,44 lít C. 3,36 lít D. 10,08 lít
Đáp án đúng là đáp án A
Hướng dẫn giải chi tiết
Phương trình hóa học
Fe+ 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O
nFe= 5,6/56 = 0,1 mol
Theo phương trình
→ nNO2 = 3nFe=0,1 x 0,3= 0,3 mol
→ V = 0,3 x 22,4 = 6,72 lít
2. Axit nitric đặc tác dụng với kim loại:
Axit nitric đặc (HNO3) là một chất hóa học quan trọng trong ngành công nghiệp hóa chất, và nó có nhiều ứng dụng quan trọng trong việc tác động lên kim loại. Axit nitric đặc thường được sử dụng để tạo ra các hợp chất nitrat và trong quá trình làm sạch, tẩy rửa kim loại. Dưới đây là một số tác dụng quan trọng của axit nitric đặc khi tác động với kim loại:
– Tạo hợp chất Nitrat:
Axit nitric đặc tác động mạnh với kim loại, tạo thành các hợp chất nitrat. Ví dụ, khi tác động lên đồng, nó tạo ra nitrat đồng (II) và nitrat đồng (III). Các hợp chất nitrat này có thể được sử dụng trong sản xuất phân bón, thuốc nổ, và các sản phẩm hóa học khác.
2HNO3+Cu→Cu(NO3)2+NO2+H2O
– Tạo Oxide kim loại:
Axit nitric còn có khả năng oxi hóa kim loại, tạo ra các oxide kim loại. Ví dụ, khi tác động lên sắt, nó tạo ra oxide sắt (III) và nitric oxide.
6HNO3+2Fe→2Fe(NO3)3+3H2O+4NO
– Tạo lớp bảo vệ:
Axit nitric đặc có thể được sử dụng để tạo lớp bảo vệ trên bề mặt kim loại. Lớp bảo vệ này giúp ngăn chặn quá trình ăn mòn và làm tăng tính bền của kim loại trong môi trường ăn mòn.
– Kiểm tra độ tinh khiết:
Trong phân tích hóa học, axit nitric đặc cũng được sử dụng để kiểm tra độ tinh khiết của kim loại. Kim loại có độ tinh khiết cao sẽ không bị ăn mòn nhanh chóng khi tác động axit nitric.
Ví dụ:
8Fe + 30HNO3 → 8Fe(NO3)3 + 3N2O + 15H2O (1)
Fe + 6HNO3đặc nóng → Fe(NO3)3 + 3NO2 + 3H2O (2)
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O (3)
Khi giải bài tập về phần axit nitric đặc nóng thường vận dụng bảo toàn e và bảo toàn nguyên tố.
Chú ý: Fe, Al, Cr bị thụ động hóa trong dung dịch HNO3 đặc, nguội.
3. Axit nitric đặc tác dụng với phi kim:
Axit Nitric Đặc (HNO3) là một chất hóa học quan trọng có nhiều ứng dụng rộng rãi trong lĩnh vực hóa học và công nghiệp. Mặc dù nó có thể tác động với nhiều loại vật liệu, chúng ta sẽ tập trung vào cách axit nitric đặc tác động với phi kim, nhóm vật liệu không chứa kim loại.
– Tạo hợp chất Nitrat:
Axit nitric đặc có khả năng tác động với phi kim, tạo ra các hợp chất nitrat. Ví dụ, khi nó tác động lên amoniac (NH3), nó tạo thành nitrat amoni (NH4NO3). Hợp chất này thường được sử dụng trong sản xuất phân bón và là một nguồn năng lượng trong các chất nổ.
HNO3+NH3→NH4NO3
– Các hợp chất hữu cơ:
Axit nitric đặc thường được sử dụng trong các phản ứng nitration của các hợp chất hữu cơ. Điều này thường xảy ra khi axit nitric tác động với các hidrocarbon không no, tạo ra các hợp chất nitro. Các hợp chất này có ứng dụng rộng trong sản xuất chất nổ, dược phẩm và một số hợp chất hữu ích khác.
HNO3+C6H6→C6H5NO2+H2O
– Tạo hợp chất Nitroso và Nitrosoamino:
Axit nitric cũng có khả năng tạo ra các hợp chất nitroso và nitrosoamino khi tác động với phi kim. Các hợp chất này có ý nghĩa quan trọng trong nghiên cứu hóa học và y học, chẳng hạn như trong quá trình tổng hợp các hợp chất chống ung thư.
HNO3+NH2OH→H2O+H2NO2
– Quá trình Nitrosation:
Axit nitric có thể tham gia vào quá trình nitrosation, biến đổi các hợp chất hữu cơ thành nitrosoamino và các dẫn xuất khác. Quá trình này có ý nghĩa đặc biệt trong nghiên cứu về sinh hóa và y học.
– Phản ứng với Cyanide:
Axit nitric còn có khả năng phản ứng với cyanide, tạo ra các dẫn xuất nitroso cyanide. Quá trình này có thể có ứng dụng trong xử lý nước và loại bỏ cyanide từ các quá trình công nghiệp.
Axit nitric đặc là một chất hóa học mạnh mẽ, và việc tác động của nó với phi kim mang lại nhiều ứng dụng quan trọng. Tuy nhiên, cần phải lưu ý đến tính chất ăn mòn và độ nguy hiểm của axit nitric, đặc biệt là khi sử dụng trong các quy trình công nghiệp và nghiên cứu. Sự hiểu biết kỹ thuật và an toàn về axit nitric là quan trọng để đảm bảo sự thành công và an toàn trong các ứng dụng của nó.
4. Bài tập minh hoạ:
Ví dụ 1: Cho 5,6 gam Fe tác dụng hết với dung dịch HNO3 (dư). Sau phản ứng sinh ra V lít khí NO2 (ở đktc, sản phẩm khử duy nhất). Tính thể tích khí sinh ra?
A. 6,72 lít B. 13,44 lít C. 3,36 lít D. 10,08 lít
Đáp án hướng dẫn giải chi tiết
Phương trình hóa học
Fe+ 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O
nFe= 5,6/56 = 0,1 mol
Theo phương trình
→ nNO2 = 3nFe=0,1 x 0,3= 0,3 mol
→ V = 0,3 x 22,4 = 6,72 lít
Lưu ý: Xem phương trình số (2)
Ví dụ 2. Cho 5,6 gam Fe tác dụng hết với dung dịch HNO3 loãng (dư). Sau phản ứng sinh ra V lít khí N2O (ở đktc, sản phẩm khử duy nhất). Tính thể tích khí sinh ra?
A. 2,24 lít B. 1,68 lít C. 3,36 lít D. 0,84 lít
Đáp án hướng dẫn giải chi tiết
Phương trình hóa học
8Fe + 30HNO3 → 8Fe(NO3)3 + 3N2O + 15H2O
nFe = 5,6/56 = 0,1 mol
Theo phương trình
→ nN2O = 3/8nFe= 0,1 x 3/8 = 0,0375 mol
→ V = 0,0375 x 22,4 = 0,84 lít
Lưu ý: Xem phương trình số (1)
Ví dụ 3. Cho 5,6 gam Fe tác dụng hết với dung dịch HNO3 (dư). Sau phản ứng sản phẩm sinh ra NO sản phẩm khử duy nhất. Tính khối lương muối thu được?
A. 2,24 lít B. 3,36 lít C. 4,48 lít D. 6,78 lít
Đáp án hướng dẫn giải chi tiết
Phương trình hóa học
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O
nFe = 5,6/56 = 0,1 mol
Theo phương trình
→ nNO = nFe= 0,1 x 1 = 0,1 mol
→ V = 0,1 x 22,4 = 2,24 lít
Lưu ý: Xem phương trình số (3)
Ví dụ 4. Hoà tan hoàn toàn m g bột Cu trong 800 g dung dịch HNO3 được dung dịch Y và 2,24 lit khí NO (đktc). Y tác dụng vừa đủ với 300 ml dung dịch NaOH 2M được kết tủa R. Sau khi nung R đến khối lượng không đổi thu được 20 g chất rắn.
a. Tính khối lượng Cu ban đầu.
b. Tính khối lượng các chất trong Y và nồng độ % của dung dịch HNO3 đã dùng
Đáp án hướng dẫn giải chi tiết
nNO = 2,24/22,4 = 0,1 mol; nNaOH = 0,3.0,2 = 0,06 mol
a. Khi cho Y tác dụng với dung dịch NaOH thu được kết tủa R chỉ chứa Cu(OH)2.
Chất rắn thu được khi nung là CuO => nCuO = 20/80 = 0,25 mol
=> nCu(OH )2 = nCuO = 0,25 mol.
Theo định luật bảo toàn nguyên tố:
nCu (ban đầu) = nCu (trong CuO) = 0,25 mol => mCu = 0,25.64 = 16 g
b. Trong X, nCu2+ = nCu(OH)2 = 0,25 mol => mCu(NO3)2 = 188.0,25 = 47 g
Cu → Cu2+ + 2e
0,25 mol 0,5 mol
Mà: N+5 + 3e → N+2
0,3 mol 0,1 mol
Vậy chứng tỏ phản ứng của Cu và HNO3 phải tạo ra NH4NO3.
ne (Cu nhường) = Σne nhận = 0,5 mol => ne nhận N+5 →N-3 = 0,5 – 0,3 = 0,2 mol
N+5 + 8e → N-3
0,2 mol 0,025 mol
nNH4NO3 = 0,025 mol => mNH4NO3 = 80.0,025 = 2 g
Theo định luật bảo toàn nguyên tố:
n HNO3 pư = nN (trong Cu(NO3)2 ) + nN (trong NO) + nN (trong NH4NO3)
= 2nCu(NO3)2 + nNO + 2nNH4NO3 = 0,65 mol
Nếu sử dụng công thức tính nhanh ở trên ta có:
nHNO3 pư = 4.nNO + 10.nNH4NO3 = 4.0,1 + 10.0,25 = 0,65 mol
mHNO3 = 63.0,65 = 40,95 g => C% = 40,95/800.100% = 5,12%
Ví dụ 5. Cho m gam Mg, Zn, Al, Cu tác dụng hết với HNO3 thu được 16,8 lít hỗn hợp khí Z: NO, NO2 ,N2, N2O (không tạo muối amoni). Số mol NO và N2O bằng nhau. Tỉ khối của Z so với H2 là 18,5. Số mol HNO3 phản ứng
Đáp án hướng dẫn giải
NO và N2O có số mol bằng nhau => quy đổi 2 khí này thành: NO2, N2
Hỗn hợp khí Z coi như gồm N2 (x mol), NO2 (y mol)
MZ = 18,5.2= 37
nZ = V/22,4 = 0,75 mol
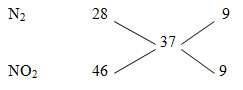
nN2/nNO2= 9/9 = 1/1
=> nN2 = nNO2 = 0,75/2 = 0,375 mol
Gọi công thức chung của hỗn hợp kim loại là M, hóa trị n
M0 → +ne
a na
2N+5 + 10e → N20
0,75 ← 3,75 ← 0,375
N+5 +1e → N+4
0,375 ← 0,375 ← 0,375
Bảo toàn e: na = 3,75 + 0,375= 4,125 => na = 4,125
nHNO3 = n. nFe(NO3)n + nNO2 + 2nN2 = 4,125 + 0,375 +2.0,375 = 5,25 mol
Ví dụ 6. Thể tích dung dịch HNO3 1M loãng ít nhất cần dùng để hoà tan hoàn toàn 9 gam hỗn hợp gồm Fe và Cu trộn theo tỉ lệ mol 1 : 1 là (biết phản ứng tạo chất khử duy nhất là NO)
A.1,0 lít B. 0,6 lít C.0,8 lít D.0,4 lít
Đáp án hướng dẫn giải chi tiết
Gọi nFe = nCu = a mol. Theo đầu bài ta có
=> 56a + 64a = 9
=> a = 0,075 mol
Do thể tích dung dịch HNO3 cần dùng ít nhất, nên sắt sẽ bị hòa tan hết bởi HNO3 vừa đủ tạo muối Fe3+, Cu tác dụng vừa đủ với Fe3+ tạo muối Cu2+ và Fe2+ => sau phản ứng chỉ thu được hai muối Cu(NO3)2 và Fe(NO3)2
Fe → Fe2+ + 2e
0,075 → 0,15
Cu → Cu2+ + 2e
0,075 → 0,15
=> ∑ne cho = 2.(0,075 + 0,075) = 0,3 mol
=> ne nhận = 3.nNO= 0,3 => nNO = 0,1 mol
Ta có:nNO− 3nNO3− = ne cho = 0,3 mol
Bảo toàn nguyên tố N:
nHNO3 = nNO3− + nNO= 0,3 + 0,1 = 0,4 mol
=> VHNO3 = 0,4/1 = 0,4 lít
Ví dụ 7. Hoà tan hết hỗn hợp A gồm Zn và ZnO trong dung dịch HNO3 loãng dư thấy không có khí bay ra và trong dung dịch chứa 56,7gam Zn(NO3)2 và 4 gam NH4NO3. Phần trăm khối lượng Zn trong A là
A. 33,33% B. 66,67% C. 61,61% D. 50,00%
Đáp án hướng dẫn giải chi tiết
Theo đề bài ta có:
nZn(NO3)2 = 0,3 mol;
nNH4NO3= 0,05 mol
ZnO tác dụng với HNO3 không sinh ra sản phẩm khử vì đã đạt số oxi hóa tối đa
Bảo toàn e: 2.nZn = 8.nNH4NO3 => nZn = 4.0,05 = 0,2 mol
Bảo toàn nguyên tố Zn: nZn(NO3)2 = nZn + nZnO => nZnO = 0,3 – 0,2 = 0,1 mol
%mZn = (0,2.65)/(0,2.65 + 0,1.81).100% = 61,61%
Ví dụ 8: Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư, thu được 1,344 lít khí NO (sản phẩm khử duy nhất) (ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là:
A. 38,72
B. 35,50
C. 49,09
D. 34,36
Đáp án hướng dẫn giải chi tiết
Xem hỗn hợp Fe, FeO, Fe2O3 và Fe3O4 chỉ gồm 2 nguyên tố Fe và O
Ta có sơ đồ: Fe: x mol; Fe(NO3)3: x mol; O : y mol
Ta có 56x + 16y = 11,36 (1)
Quá trình nhường electron:
Fe0 – 3e → Fe+3
x 3x
Quá trình nhận electron:
O+0 + 2e → O-2
y 2y
N+5 + 3e → N+2
0,18 0,06
Áp dụng định luật bảo toàn electron, ta có: 3x = 2y + 0,18 (2)
Từ (1) và (2) → x = 0,16 mol và y = 0,15 mol
⇒ mFe(NO3)3 = 0,16. 242 = 38,72 (g)
Ví dụ 9. Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4phản ứng hết với dung dịch HNO3 loãng (dư), thu được 1,344 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Tính m ?
A. 42,18g
B. 38,72g
C. 36,27g
D. 41,24g
Đáp án hướng dẫn giải chi tiết
Số mol NO = 0,06 mol.
Quy hỗn hỗn hợp X về 2 nguyên tố Fe và O
Gọi số mol Fe và O tương ứng trong X là x và y ta có:
56x + 16y = 11,36 (1).
Quá trình nhường: Fe0 → Fe+3 + 3e
Quá trình nhận e: O0 + 2e → O-2
N+5 + 3e → N+2
Áp dụng định luật bảo toàn electron ta có: 3x = 2y + 0,18 (2)
Từ (1) và (2) => x = 0,16 và y = 0,15
=> m = 38,72 gam.
Ví dụ 10. Hoà tan hết m gam hỗn hợp X gồm Fe, Fe2O3, Fe3O4 trong dung dịch HNO3 đặc nóng thu được 4,48 lít khí màu nâu duy nhất (đktc). Cô cạn dung dịch sau phản ứng thu được 145,2 gam muối khan, giá trị m là:
A. 78,4
B. 139,2
C. 46,4
D. 46,256
Đáp án hướng dẫn giải chi tiết
Cách 1: Quy hỗn hợp X về hỗn hợp 2 chất FeO và Fe2O3 ta có:
Bảo toàn e: nFeO = nNO2 = 0,2 mol
Bảo toàn Fe: nFeO+ 2.nFe2O3 = nFe(NO3)3 = 0,6 mol
=> nFe2O3 = 0,2 mol
=> mX = 0,2.72 + 0,2.160 = 46,4 gam
Quy hỗn hợp X về 2 chất Fe và Fe2O3:
Hoà tan hỗn hợp X vào dung dịch HNO3 đặc nóng dư.
Bảo toàn e: 3.nFe = nNO2 => nFe = 0,2 / 3
nmuoikhan=nFe(NO3)3=145,2/242 = 0,6mol
Bảo toàn Fe : nFe+ 2.nFe2O3 = nFe(NO3)3 => 0,2 / 3 + 2.nFe2O3 = 0,6
=> nFe2O3 = 0,8/3
=> mh2X=mFe+ nFe2O3= 0,23.56 + 0,83.160 = 46,4 gam