Phản ứng Fe + HNO3 đặc nóng ra NO2 thuộc loại phản ứng oxi hóa khử. Dưới đây là lý thuyết và các câu hỏi, bài tập vận dụng liên quan về phương trình hóa học giúp các em học sinh ôn lại kiến thức. Xin mời các em học sinh đón xem.
Mục lục bài viết
- 1 1. Cho Fe tác dụng với dung dịch HNO3 đặc, nóng thu được khí X có màu nâu đỏ là chất gì?
- 2 2. Phản ứng Fe + HNO3 đặc nóng → Fe(NO3)3 + NO2 + H2O:
- 2.1 2.1. Điều kiện xảy ra phản ứng hóa học Fe + HNO3 đặc nóng → Fe(NO3)3 + NO2 + H2O:
- 2.2 2.2. Dấu hiệu nhận biết xảy ra phản ứng hóa học Fe + HNO3 đặc nóng → Fe(NO3)3 + NO2 + H2O:
- 2.3 2.3. Thực hiện phản ứng hóa học Fe + HNO3 đặc nóng → Fe(NO3)3 + NO2 + H2O:
- 2.4 2.4. Cân bằng phương trình hóa học Fe + HNO3 đặc nóng → Fe(NO3)3 + NO2 + H2O:
- 3 3. Bài tập vận dụng liên quan:
1. Cho Fe tác dụng với dung dịch HNO3 đặc, nóng thu được khí X có màu nâu đỏ là chất gì?
Câu hỏi: Cho Fe tác dụng với dung dịch HNO3 đặc, nóng thu được khí X có màu nâu đỏ. Khí X là?
A. N2
B. N2O
C. NO
D. NO2
Đáp án: D. NO2
Giải thích:
Khi Fe tác dụng với HNO3 đặc, nóng, Fe sẽ bị oxi hóa thành Fe3+ và HNO3 sẽ bị khử thành NO2. NO2 là một khí có màu nâu đỏ, do đó khí X là NO2.
Các phương trình phản ứng có thể viết như sau:
Fe + 6HNO3 -> Fe(NO3)3 + 3NO2 + 3H2O
Fe -> Fe3+ + 3e-
HNO3 + 3e- -> NO2 + H2O
Fe + HNO3 đặc nóng → Fe(NO3)3 + NO2 + H2O
Vậy đáp án đúng là D. NO2.
2. Phản ứng Fe + HNO3 đặc nóng → Fe(NO3)3 + NO2 + H2O:
Phản ứng hóa học giữa sắt và axit nitric đặc nóng là một phản ứng oxi hóa khử xảy ra trong điều kiện nhiệt độ cao. Khi sắt tác dụng với axit nitric đặc nóng, sắt sẽ bị oxi hóa thành ion sắt (III) và axit nitric sẽ bị khử thành khí nitơ (IV) oxiđ. Sản phẩm của phản ứng là muối sắt (III) nitrat và nước. Khí NO2 là một khí độc, gây kích ứng đường hô hấp và mắt. Nếu tiếp xúc lâu dài với khí NO2, người ta có thể bị viêm phổi, suy hô hấp hoặc ung thư phổi.
Phương trình phản ứng được viết như sau:
Fe + HNO3 đặc nóng → Fe(NO3)3 + NO2 + H2O
Phản ứng này có thể được giải thích bằng cách xét số oxi hóa của các nguyên tố trong các chất tham gia và sản phẩm. Sắt có số oxi hóa là 0 trong phân tử Fe, tăng lên +3 trong ion Fe3+. Axit nitric có số oxi hóa là +5 trong phân tử HNO3, giảm xuống +4 trong phân tử NO2. Do đó, sắt là chất bị oxi hóa và axit nitric là chất khử. Phản ứng này thuộc loại phản ứng thế đơn, vì một nguyên tố thay thế một nguyên tố khác trong một hợp chất.
* Cơ chế phản ứng được mô tả như sau:
– Sắt tác dụng với axit nitric đặc nóng, tạo ra ion sắt(III) và ion nitrat.
Fe + 6HNO3 → Fe3+ + 6NO3- + 3H2
– Ion sắt(III) kết hợp với ion nitrat, tạo ra muối sắt(III) nitrat.
Fe3+ + 3NO3- → Fe(NO3)3
– Ion nitrat bị khử, tạo ra khí nitơ(IV) oxit và nước.
4HNO3 → 4NO2 + 2H2O + O2
2.1. Điều kiện xảy ra phản ứng hóa học Fe + HNO3 đặc nóng → Fe(NO3)3 + NO2 + H2O:
Để biết được điều này, chúng ta cần hiểu về tính chất của các chất tham gia và sản phẩm trong phản ứng.
Fe là kim loại có tính khử mạnh, có thể phản ứng với các axit mạnh như HNO3 để tạo ra muối và khí. Tuy nhiên, Fe không phản ứng với HNO3 loãng ở nhiệt độ thường, vì HNO3 loãng có tính oxi hóa yếu, không đủ để oxi hóa Fe thành Fe2+ hay Fe3+. Do đó, để xảy ra phản ứng, cần dùng HNO3 đặc và nóng, có tính oxi hóa mạnh hơn.
Trong phản ứng, Fe bị oxi hóa thành Fe3+, tạo ra muối Fe(NO3)3. HNO3 đặc nóng bị khử thành NO2, một khí màu nâu đỏ, có mùi khai. Ngoài ra, còn có sự giải phóng nhiệt và sinh ra nước.
Phương trình phản ứng:
Fe + 6HNO3 đặc nóng → Fe(NO3)3 + 3NO2 + 3H2O
Để xác định điều kiện xảy ra phản ứng, chúng ta cần biết về nồng độ của HNO3 và nhiệt độ của dung dịch. Để xảy ra phản ứng, nồng độ của HNO3 cần từ 65% trở lên và nhiệt độ của dung dịch cần từ 80°C trở lên. Nếu nồng độ hoặc nhiệt độ thấp hơn, phản ứng sẽ không xảy ra hoặc xảy ra rất chậm.
Vậy, điều kiện xảy ra phản ứng hóa học Fe + HNO3 đặc nóng → Fe(NO3)3 + NO2 + H2O là: HNO3 có nồng độ từ 65% trở lên và dung dịch có nhiệt độ từ 80°C trở lên.
2.2. Dấu hiệu nhận biết xảy ra phản ứng hóa học Fe + HNO3 đặc nóng → Fe(NO3)3 + NO2 + H2O:
– Xuất hiện khí màu nâu đỏ bay lên, đó là khí nitơ(IV) oxit.
– Dung dịch màu vàng nhạt ban đầu chuyển sang màu đỏ cam, đó là do có sự hình thành muối sắt(III) nitrat.
– Nhiệt độ dung dịch tăng lên, đó là do phản ứng tỏa nhiệt.
2.3. Thực hiện phản ứng hóa học Fe + HNO3 đặc nóng → Fe(NO3)3 + NO2 + H2O:
* Để thực hiện phản ứng này, ta cần chuẩn bị các dụng cụ và chất hóa học sau:
– Một ống nghiệm
– Một miếng sắt
– Dung dịch axit nitric đặc
– Một bình kính chứa nước vôi trong
– Một ống dẫn khí.
* Các bước tiến hành như sau:
– Cho miếng sắt vào ống nghiệm, đổ dung dịch axit nitric đặc vào cho đủ ngập miếng sắt.
– Đun nóng ống nghiệm trên ngọn lửa cho đến khi xuất hiện khí màu nâu thoát ra.
– Dùng ống dẫn khí dẫn khí thoát ra từ ống nghiệm vào bình kính chứa nước vôi trong.
– Quan sát hiện tượng xảy ra trong bình kính và trong ống nghiệm.
* Kết quả thu được:
– Trong ống nghiệm, dung dịch có màu vàng nhạt do có muối nitrat sắt (III) Fe(NO3)3 tan trong dung dịch.
– Trong bình kính, dung dịch nước vôi trong bị đục do có khí nitơ (IV) oxi NO2 tác dụng với nước vôi trong tạo thành kết tủa trắng là canxi nitrit Ca(NO2)2 và canxi hidroxit Ca(OH)2.
* Để thực hiện phản ứng này, cần lưu ý những điều sau:
– Sử dụng HNO3 đặc nóng, vì HNO3 loãng hoặc nguội không tác dụng được với Fe.
– Sử dụng Fe dạng bột hoặc dây mỏng để tăng diện tích tiếp xúc và tốc độ phản ứng.
– Đặt bình chứa Fe và HNO3 trong bể nước nóng để duy trì nhiệt độ cao.
– Đeo khẩu trang và găng tay bảo hộ, vì khí NO2 sinh ra có màu nâu đỏ, độc hại và gây kích ứng đường hô hấp.
– Thu khí NO2 bằng cách dẫn qua dung dịch NaOH để tạo ra muối natri nitrit NaNO2.
2.4. Cân bằng phương trình hóa học Fe + HNO3 đặc nóng → Fe(NO3)3 + NO2 + H2O:
– Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hoá, từ đó xác định chất oxi hoá – chất khử: ![]()
Chất khử: Fe; chất oxi hoá: HNO3.
– Bước 2: Biểu diễn quá trình oxi hoá, quá trình khử
+ Quá trình oxi hoá: ![]()
+ Quá trình khử: ![]()
– Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hoá
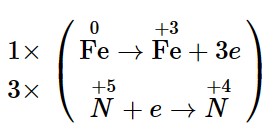
– Bước 4: Điền hệ số của các chất có mặt trong phương trình hoá học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
Fe + 6HNO3 đặc, nóng → Fe(NO3)3 + 3NO2 + 3H2O
2.5. Ứng dụng của phương trình hóa học Fe + HNO3 đặc nóng → Fe(NO3)3 + NO2 + H2O:
– Trong công nghiệp, phản ứng này được dùng để sản xuất muối sắt (III) nitrat, một chất có tính oxi hóa mạnh, được dùng trong thuốc nổ, thuốc súng hoặc thuốc nhuộm.
– Trong phòng thí nghiệm, phản ứng được dùng để xác định sắt trong mẫu thử. Khi cho dung dịch HNO3 đặc nóng vào mẫu thử chứa sắt, nếu có sự xuất hiện của khí NO2 màu nâu đỏ và dung dịch có màu vàng nhạt, ta có thể kết luận rằng mẫu thử chứa sắt.
– Trong y học, phản ứng được dùng để điều trị các loại sùi mào gà hoặc polyp âm đạo. Khi tiêm dung dịch HNO3 đặc nóng vào các tổ chức bị bệnh, HNO3 sẽ gây hoại tử các tế bào bệnh lý và giúp loại bỏ chúng.
3. Bài tập vận dụng liên quan:
Câu 1: Cho 11,2 gam Fe tác dụng hết với dung dịch H2SO4 loãng dư, thu được V lít khí H2 (đktc). Giá trị của V là:
A. 2,24
B. 3,36
C. 4,48
D. 6,72
Đáp án: C
Hướng dẫn chi tiết:
Áp dụng định luật bảo toàn electron:
2.nFe = 2.
→ = nFe = 0,2 mol
→ V = 0,2.22,4 = 4,48 lít
Câu 2: Cho 6 gam Fe vào 100ml dung dịch CuSO4 1M. Sau khi phản ứng xảy ra hoàn toàn thu được m gam hỗn hợp kim loại. Giá trị của m là:
A. 7,0
B. 6,8
C. 6,4
D. 12,4
Đáp án: B. 6,8
Hướng dẫn chi tiết:
nFe = 6 : 56 = 0,107 mol
= 0,1.1 = 0,1 mol
Fe + CuSO4 → FeSO4 + Cu
→ Fe còn dư
→ nCu = nFe phản ứng =
nCuSO4 = 0,1 mol
Khối lượng hỗn hợp kim loại thu được là:
m = 6 – 0,1.56 + 0,1.64 = 6,8 gam
Câu 3: Hòa tan 5,6g Fe bằng dung dịch HNO3 loãng (dư), sinh ra V lít khí NO (sản phẩm khử duy nhất, đktc). Giá trị của V là:
A. 2,24.
B. 3,36.
C. 4,48.
D. 6,72.
Đáp án: A. 2,24
Hướng dẫn chi tiết:
Bảo toàn số mol electron
→ 3nFe = 3nNO → nNO = nFe = 0,1 → V = 2,24 lít




